Перейти к:
Электрохимия восстановительных процессов и перспективы развития восстановительных технологий
https://doi.org/10.17073/0368-0797-2025-4-424-433
Аннотация
Окисление и восстановление металлов заключаются в потере атомами металлов валентных электронов с преобразованием электромагнитной металлической связи в ионную при окислении и обратный переход электронов от анионов к катионам металла с превращением ионной связи в металлическую при восстановлении. Развиваемая авторами электронная теория восстановления описывает процесс восстановления последовательной работой двух электрохимических элементов: топливного, в котором химическая энергия окисляемого восстановителя превращается в электрическую энергию «свободных» электронов, и твердоэлектролитного электролизера, превращающего электрическую энергию этих электронов в энергию металлической связи восстанавливаемых катионов в оксиде. Так как стадией собственно восстановления является образование металлической связи между катионами за счет поступающих извне электронов, то самым коротким и потому самым эффективным будет подвод электронов к восстанавливаемым катионам не от топливного элемента, а из электрической сети, то есть электролиз оксидов восстанавливаемого металла. Известные способы получения железа электролизом расплавленных оксидов, а также, возможно, щелочных растворов являются перспективными при извлечении железа из богатых руд. Для селективного извлечения железа из железомарганцевых, титаномагнетитовых, сидеритовых, хромитовых и других комплексных руд более перспективным является относительно низкотемпературное восстановление железа водородом или твердофазный электролиз с получением после разделения продукта металлизации плавлением безуглеродистого железа и концентрата оксидов активных металлов.
Ключевые слова
Для цитирования:
Рощин В.Е., Рощин А.В. Электрохимия восстановительных процессов и перспективы развития восстановительных технологий. Известия высших учебных заведений. Черная Металлургия. 2025;68(4):424-433. https://doi.org/10.17073/0368-0797-2025-4-424-433
For citation:
Roshchin V.E., Roshchin A.V. Electrochemistry of reduction processes and prospects for the development of reduction technologies. Izvestiya. Ferrous Metallurgy. 2025;68(4):424-433. https://doi.org/10.17073/0368-0797-2025-4-424-433
Введение
Существующие в настоящее время способы восстановления и извлечения металлов из руд зародились задолго до появления науки и сложились в результате совершенствования ремесла получения металлов. Более того, практика превращения руды в металл в значительной степени сама была побуждающей причиной появления науки о превращении вещества: сначала в виде алхимии, а позднее и собственно химии. Лишь в конце XIX века благодаря развитию атомно-молекулярных представлений на основе достижений науки о химических реакциях появились первые научные объяснения механизма процессов, протекающих при восстановлении металлов [1 – 3].
В настоящее время нет сомнений в том, что атомы и молекулы существуют только в газовой фазе: в конденсированных металлах нет атомов, а в оксидах руды нет молекул. И там, и там металлы находятся в виде катионов и «потерянных» атомами валентных электронов, которые тем или иным способом связывают катионы металлов электромагнитным полем в конденсированную фазу: в металлах – металлической, а в оксидах – ионной связью. Несомненно также, что суть процессов окисления и восстановления металлов заключается в перераспределении валентных электронов атомов, и эти процессы необходимо представлять реакциями потери атомами металлов валентных электронов с переходом их к атомам окислителя и изменением металлической электромагнитной связи на ионную (Ме 0 = Ме 2+ + 2е) при окислении и возвращения этих электронов от анионов окислителя катионам с возвращением катионов к металлической связи при восстановлении (Ме 2+ + 2е = Ме 0 ). Таким образом, восстановление и окисление – это электрохимические процессы, обусловленные перераспределением валентных электронов атомов металлов. Однако в металлургической науке при описании процессов восстановления металлов из руд до сих пор безраздельно господствует атомно-молекулярный подход [4; 5]. Явно устаревшее научное описание процессов восстановления на атомно-молекулярном уровне, например, С + FeO = CO + Fe, не способствует совершенствованию должным образом технологических процессов, приведению их в соответствие с современным уровнем науки [6 – 8].
Электронная теория восстановления
Развиваемая в последние годы авторами с коллегами электронная теория восстановления [9; 10] имеет целью описание электрохимических процессов обмена электронами между окисляемыми атомами восстановителя и катионами восстанавливаемого металла. Эта теория основана на результатах большого количества собственных специальных экспериментов и обобщении известных результатов других авторов. Теория исходит из электрохимической природы реакций восстановления, учитывает изменение структуры твердых руд (появление анионных вакансий вследствие низкого парциального давления кислорода PO2 и высокой температуры Т ≈ 2000 °С) и соответствующего этим параметрам состава газовой фазы (образование низкотемпературной плазмы) при нагреве в восстановительных агрегатах, базируется на физике несовершенных кристаллов, положениях квантовой механики об особенностях распределения и перемещения электронов в металлах и ионных полупроводниках. Выводы теории охватывают все известные результаты восстановления с образованием металла на поверхности кусков богатых моноруд, выделение металла внутри комплексных и бедных руд, диссоциацию оксидов, образование и сублимацию субоксидов, а также получение металлов электролизом из жидких растворов и расплавленных солей.
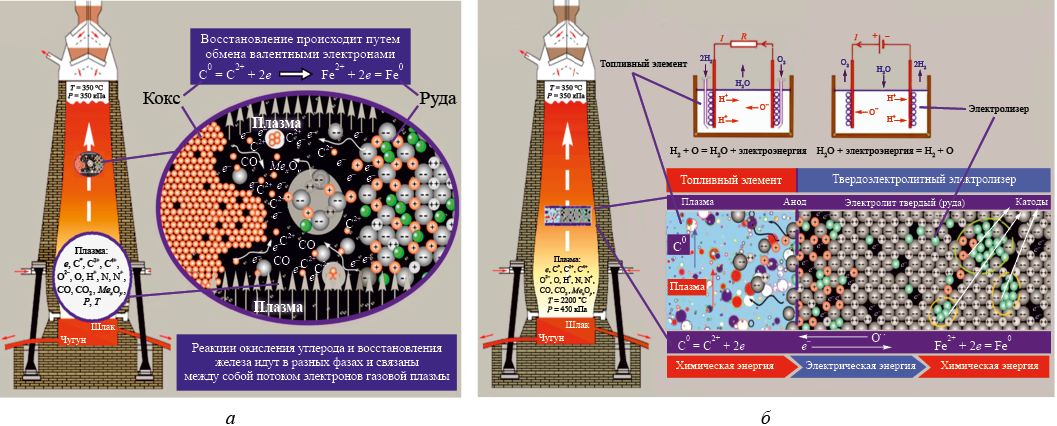
Согласно теории, в условиях высоких температур и низкого парциального давления кислорода в газовой фазе восстановительных агрегатов для протекания химических реакций между твердыми оксидами руд и твердым углеродом кокса даже не требуется непосредственного контакта твердых реагентов. Плазменное состояние газовой фазы позволяет ионам и электронам, присутствующим в самой плазме и на поверхности соприкасающихся с плазмой твердых реагентов, взаимодействовать под действием электрических зарядов на расстоянии, сближаться и вступать в химические реакции в газовой фазе, что обеспечивает протекание реакций твердофазного восстановления с высокой скоростью в кинетическом режиме (рис. 1, а).
Рис. 1. Электрохимические процессы в доменной печи: |
Новым и принципиально важным положением электронной теории восстановления является теоретически обоснованный и многократно подтвержденный специальными экспериментами с комплексными и бедными рудами механизм передачи электронов от восстановителя катионам восстанавливаемого металла, то есть механизм твердофазного восстановления. Он заключается в образовании и перемещении в кристаллической решетке каждого куска оксида анионных вакансий со «свободными» (не связанными конкретно с каким-либо катионом) электронами, источником которых является химическая реакция между восстановителем и кислородом оксида в газовой фазе. Низкое парциальное давление кислорода в газовой фазе, обусловленное химическим взаимодействием с восстановителем, и высокая подвижность ионов кристаллической решетки оксида вследствие высокой температуры вызывают переход кислорода из оксида в газовую фазу. Покидая кристаллическую решетку оксида и принимая в газовой фазе два электрона от восстановителя, атом кислорода оставляет в решетке анионную вакансию и связанные с ней два «свободных» электрона, ранее захваченных анионом кислорода у катионов металла.
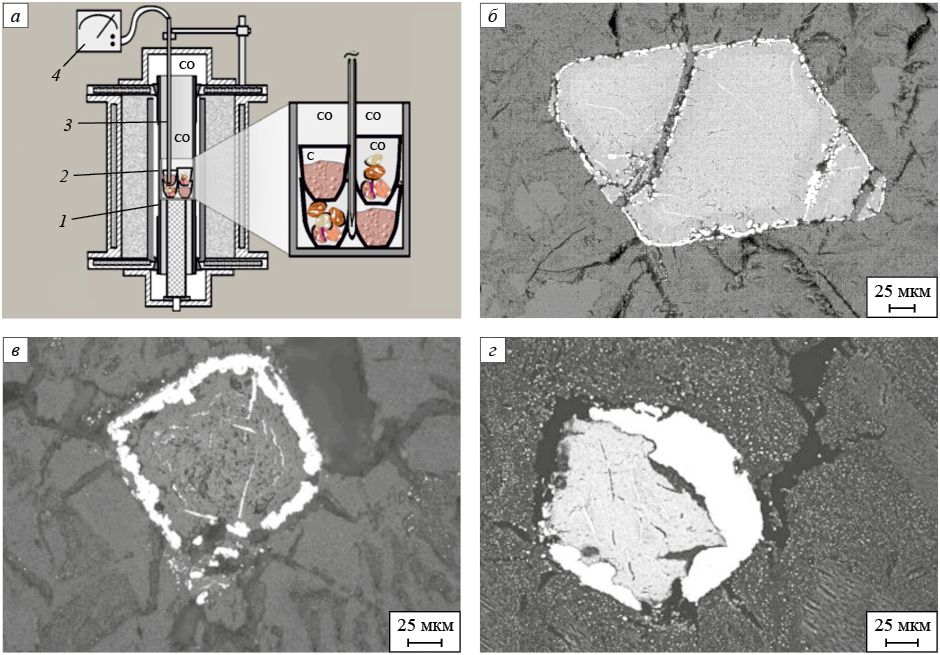
Вследствие развитого теплового движения ионов анионные вакансии и связанные с ними «свободные» электроны рассеиваются в решетке комплексных оксидов и перемещаются до встречи с катионами, обладающими высоким сродством к электрону (уровнем Ферми) [11]. В местах скопления таких катионов перемещение заряженных электронами вакансий прекращается, вакансии сливаются, а на их месте за счет поступивших с вакансией «свободных» электронов образуется металлическая связь и выделяется металлическая фаза. Таким образом, удаление атомарного кислорода с поверхности одной оксидной фазы может приводить к селективному восстановлению катионов с высоким сродством к электронам в кристаллической решетке другого оксида. Пример такого восстановления представлен на рис. 2, где показана схема проведения и результаты экспериментов по твердофазному восстановлению твердым углеродом катионов железа и хрома в кристаллах хромшпинелида (Mg, Fe)[Fe, Al, Cr]2O4 , вкрапленных в оливин (Mg, Fe)2[SiO4 ].
Рис. 2. Схема установки на базе печи Таммана для проведения экспериментов |
Согласованное перемещение «свободных» электронов и анионных вакансий в восстановительных условиях среды происходит без наложения внешнего электрического поля вследствие разности химических потенциалов кислорода и электронов на поверхности и в объеме оксидной фазы. «Свободные» электроны могут перемещаться также по анионным вакансиям другого (теплового или примесного) происхождения, если при этом не нарушается общее и локальное равенство положительных и отрицательных электрических зарядов.
Таким образом, восстановительный процесс в восстановительных агрегатах следует представлять как совокупность работы двух последовательных электрохимических элементов: углеродного топливного элемента, в котором химическая энергия окисляемого восстановителя превращается в электрическую энергию «свободных» электронов, и твердоэлектролитного электролизера, в котором эта электрическая энергии переместившихся с поверхности в объем оксида электронов поглощается катионами и превращается в химическую энергию металлической связи (рис. 1, б). В восстановительных агрегатах такими последовательно работающими парами электрохимических элементов (топливных элементов и электролизеров) являются газовая фаза и каждый кусок руды. Благодаря бесчисленному количеству этих электрохимических элементов (кусков руды) достигается гигантская производительность восстановительных агрегатов, в частности, доменных печей.
Перспективы трансформации углеродных технологий восстановления
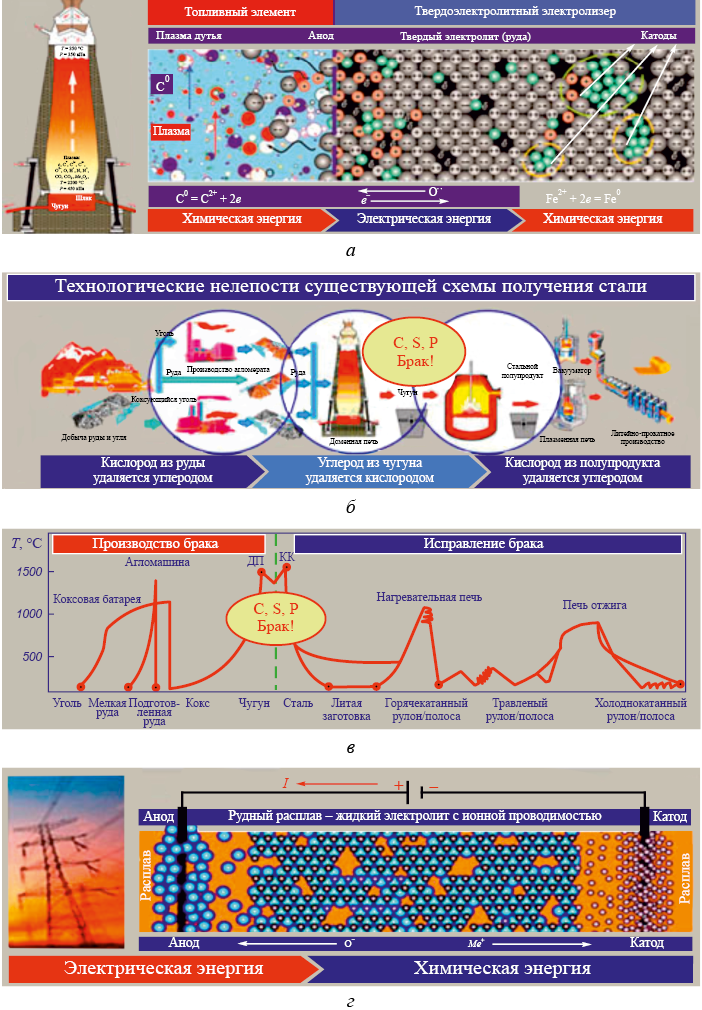
Электрохимическая природа процессов окисления/восстановления в настоящее время уже не должна быть предметом дискуссий. Следовательно, не должно вызывать сомнений и наличие в восстановительных агрегатах потока электронов между восстановителем и катионами восстанавливаемого металла, то есть протекания между ними электрического тока. Электронная теория описывает механизм появления и преобразования тока как результат последовательной работы двух электрохимических элементов: топливного преобразователя химической энергии в электрическую и электролизера. Этот механизм не противоречит практике работы восстановительных агрегатов всех типов и подтвержден многочисленными результатами специальных экспериментов с разными рудами и разными восстановителями. На основании изложенного следует сделать вывод о том, что заключительной стадией всех используемых в настоящее время технологий многостадийного процесса восстановления металлов всегда является переход «свободных» электронов от атомов восстановителя к катионам восстанавливаемого металла с выделением атомарного кислорода на поверхности оксида и металла в оксидной фазе, то есть твердоэлектролитный электролиз руды.
В связи с этим возникает вопрос о необходимости многочисленных дорогостоящих предшествующих и промежуточных стадий процесса восстановления и целесообразности генерации «свободных» электронов в топливном элементе агрегатов извлечения железа из руд. Очевидно, что генерировать «свободные» электроны несравненно проще и дешевле не путем сжигания восстановителя в металлургических восстановительных агрегатах, а современными методами на электростанциях, передавать их по электрической сети и сразу использовать на последней стадии восстановления катионов в специализированном электрохимическом агрегате (в электролизере). Таким образом, существующий многостадийный и энергозатратный процесс извлечения железа из руд (рис. 3, а – в) целесообразно свести к одной заключительной стадии – электролизу (рис. 3, г). В связи с этим, извлечение металлов из руд электролизом представляется конечной целью трансформации существующих металлургических технологий.
Элетролиз расплавленных солей и оксидов давно используется для восстановления и производства в промышленных масштабах ряда металлов, например, алюминия [12]. Достаточно давно ведутся работы по разработке устройств и процессов извлечения путем электролиза железа из водных растворов его солей [13]. В последнее время некоторые фирмы интенсифицировали исследования по разработке устройств и процессов получения железа электролизом расплавленных оксидов [14 – 16]. Однако в целом к перспективам получения железа электролизом у практических специалистов и, что особенно важно, у научного сообщества отношение пока не только скептическое, а скорее даже негативное.
До сих пор оправданием производства чугуна с последующим переделом его в сталь является колоссальная производительность доменных печей, доступность и относительно невысокая стоимость углеродных материалов, используемых в качестве источника тепловой энергии и одновременно в качестве восстановителей. Но следует помнить, что эта технология исторически появилась и развивалась вследствие необходимости передела брака, когда в сыродутном горне в результате повышения температуры и насыщения железа углеродом был получен брак: хрупкий чугун вместо малоуглеродистого пластичного железа. Производство и передел брака оказались целесообразными благодаря доступности и относительно невысокой стоимости углеродсодержащих восстановителей (сначала дров, затем последовательно древесного и каменного углей). В настоящее время для производства чугуна используется самое дорогое твердое топливо – кокс, который получают из дефицитных сортов угля по сложной и экологически опасной технологии. В связи с дефицитом качественных коксующихся углей цена кокса непрерывно растет, а обеспечивать все возрастающие требования к качеству кокса становится все сложнее. При этом в доменных печах в связи с характером процессов восстановления теплотворная способность этого самого дефицитного и дорогого восстановителя не может быть использована более чем на 25 %, так как в процессе восстановления железа углерод кокса окисляется до оксида СО, а 75 % энергии выделяется уже при нецелевом «дожигании» СО до СО2 [17].
Крайне низкое целевое (на восстановление) использование кокса к тому же сопровождается еще и растворением части углерода в железе с превращением железа в чугун. Эта растворившаяся часть углерода кокса является не просто потерей, а уже вредной примесью, которую при переделе чугуна в сталь удаляют продувкой чугуна кислородом, окисляя попутно и заметное количество ранее восстановленного в доменных печах коксом же железа (рис. 3, б). Окисленный расплав железа далее необходимо раскислить, в том числе тем же углеродом. С учетом еще и огромных тепловых потерь в многостадийном технологическом процессе превращения «брака» в целевой продукт производство по схеме «чугун – сталь» следует оценивать как крайне неэффективное, категорически не соответствующее требованиям энерго- и ресурсосбережения и не отвечающее современному уровню развития науки. На стадии передела чугуна в сталь к необходимости удаления первопричины брака (лишнего углерода) добавилась необходимость удалять также вносимые преимущественно на стадии получения чугуна коксом и добавочными материалами серу и фосфор. Таким образом, современная схема производства чугуна и последующего передела чугуна в сталь, по-сути, является процессом производства и исправления брака (рис. 3, б, в).
Рис. 3. Преобразования и потери энергии при использовании углеродного топливного элемента |
Учитывая непоследовательность существующей схемы производства (чередующиеся этапы восстановление – окисление, загрязнение – рафирование, нагрев – охлаждение) (рис. 3, в), затраты на добычу и логистику дефицитного коксующегося угля и производства из него кокса, на производство агломерата и дополнительных расходных материалов, на строительство современных гигантских восстановительных агрегатов, на логистику, природоохранные и экологические мероприятия, затраты на электролиз, скорее всего, могут несущественно отличаться от затрат на производство и передел чугуна. Производство железа электролизом расплавов может оказаться конкурентноспособным уже в настощее время при создании новых предприятий (рис. 3, г). К тому же, как показано выше, огромная производительность доменной печи достигается одновременной работой в ее объеме колоссально большого числа твердоэлектролитных электролизеров. Возможно, подобный принцип электровосстановления с использованием электроэнергии из электрической сети можно применить на стадии металлизации.
По-видимому, преувеличенными являются представления и о слишком высоких затратах на электроэнергию при электролизе железа. Во-первых, на получение элетролизом 1 кг железа требуется в четыре раза энергии меньше по сравнениию с таким же количеством алюминия. Во-вторых, необходимо учитывать, что запасы углей коксующихся сортов быстро сокращаются, в то время как доступность относительно дешевой электрической энергии благодаря развитию атомной энергетики увеличивается. В этой связи показательно, что интенсивные исследования электролитического производства железа ведутся в США и Франции, то есть в странах с наибольшим удельным весом атомных электростанций [14 – 16].
Водородные восстановительные процессы и технологии
Перспектива получения железа электролизом рудных расплавов представляется вполне реальной при извлечении его из богатых моноруд. В то же время имеются обширные запасы комплексных и бедных руд, трудно перерабатываемых или непригодных к переработке существующими методами. Целесообразность подготовки таких руд к электролизу расплавов представляется также сомнительной. Результаты наших исследований [18] показали, что в таких рудах железо можно восстанавливать селективно в твердой фазе, то есть при относительно низкой температуре, а после разделения продуктов металлизации плавлением получать чистое от углерода железо и концентрат оксидов невосстановленных металлов, обладающих меньшим по сравнению с железом сродством к электрону.
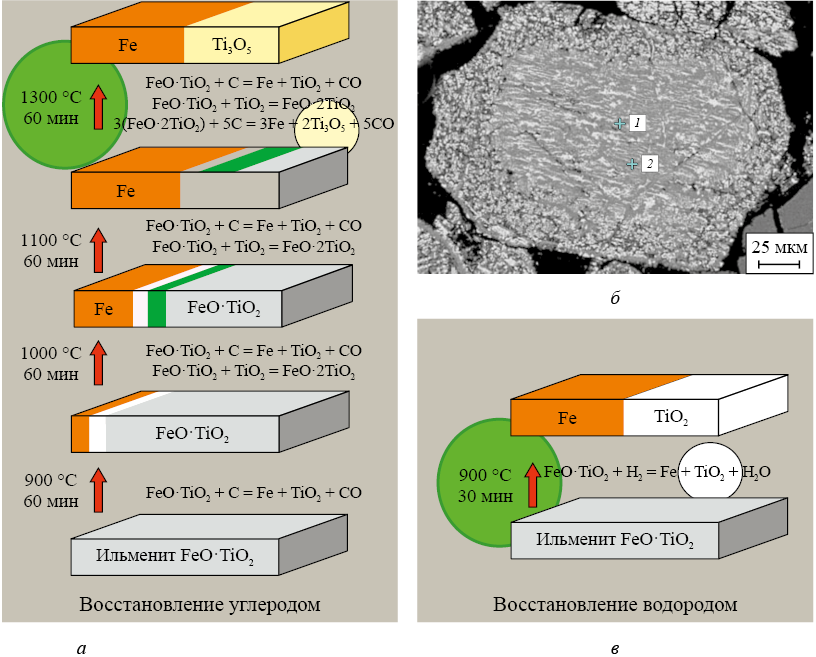
В связи с этим наряду с получением железа электролизом из богатых руд перспективными являются также исследования по селективному восстановлению железа в бедных и комплексных сидеритовых, железомарганцевых, титаномагнетитовых, ильменитовых и других рудах с получением после разделения продуктов металлизации железа и концентрата оксидов активных металлов (магния, марганца, титана, хрома и других). При этом должна решаться задача не только максимально полного восстановления и извлечения железа, но также максимально полного сохранения ценных оксидов активных металлов в оксидной фазе. Результаты проведенных исследований показывают, что наиболее успешно решить эту задачу можно, если в качестве восстановителя вместо углерода использовать водород [19].
В больших промышленных масштабах единственной реальной альтернативой углероду как восстановителю железа является водород, поскольку это самый распространенный химический элемент во Вселенной. К тому же он является и одним из самых эффективных энергоносителей: при сжигании 1 кг водорода выделяется порядка 140 МДж энергии, в то время как сжигание 1 кг бензина дает примерно 50 МДж, а 1 кг угля – 20 – 25 МДж. Но на Земле свободного водорода в концентрированном виде нет, поэтому для использования водорода в качестве энергоносителя или восстановителя его необходимо производить, извлекая из распространенных на Земле химических соединений: оксида (воды) или углеводородов. В зависимости от «углеродного следа» в производстве водорода его принято обозначать разными цветами: от «зеленого» с наименьшим «углеродным следом», получаемого электролизом воды за счет электроэнергии от возобновляемых источников энергии, до «коричневого», извлекаемого газификацией каменного угля. Наименьшим «углеродным следом» характеризуется «зеленый» водород, но одновременно он является и самым дорогим. Наиболее доступными и дешевыми способами получения водорода в настоящее время являются процессы разложения на водород и углерод ископаемых углеводородов, запасами которых богата Россия.
Благодаря ряду свойств (газовое состояние, высокое при низкой температуре и уменьшающееся при повышении температуры сродство к кислороду, ничтожная растворимость в твердом железе и другие), водород иногда оказывается более эффективным восстановителем, в частности, для селективного твердофазного восстановления железа в комплексных рудах.
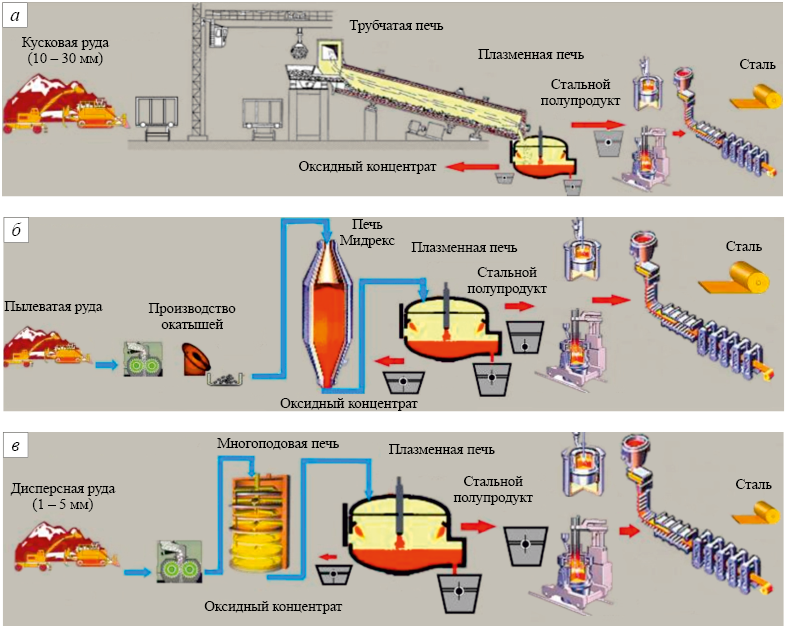
Газообразный водород не может заменить твердое топливо в доменной печи, но вполне может использоваться в качестве восстановителя в уже существующих агрегатах прямого восстановления вместо природного газа (рис. 4). Аналогично углероду в доменной печи химическая энергия водорода при сжигании за счет кислорода руды в топливном элементе восстановительного агрегата превращается в электрическую энергию, а затем за счет этой энергии происходит восстановление металла.
Рис. 4. Целесообразные схемы использования водорода в качестве восстановителя |
Анализ электрохимических процессов на основе водородного твердоэлектролитного топливного элемента показывает явные преимущества водорода по сравнению с углеродом для безотходной переработки комплексных и трудно перерабатываемых доменным процессом ильменитовых, титаномагнетитовых, железомарганцевых, сидеритовых и других руд с получением новых ценных продуктов: чистого безуглеродистого железа и ценных концентратов оксидов титана, марганца, магния и других активных металлов [18; 19]. В настоящее время для уже действующих установок существует экономически оправданная ниша использования относительно дешевых «серого» или «коричневого» водорода с целью получения из трудно перерабатываемых комплексных руд безуглеродистого мягкого железа и ценных оксидных концентратов (рис. 5).
Рис. 5. Сравнение последовательности и параметров (температуры (Т) и времени (t)) |
Что же касается восстановления железа «зеленым» водородом, производимым путем электролиза воды и часто рассматриваемым в качестве панацеи от опасных изменений климата [20 – 23], то его роль как гаранта устойчивого климата сомнительна, а экономически вряд ли когда-нибудь может быть оправдана. Это обусловлено тем, что получение и использование «зеленого» водорода в качестве восстановителя металлов включает последовательный двойной электролиз: сначала электролиз более прочного оксида водорода (воды) за счет электричества от возобновляемых источников энергии, а затем электролиз менее устойчивого оксида железа за счет электрической энергии водородного топливного элемента. К тому же, получение безуглеродистого железа путем восстановления «зеленым» водородом в дальнейшем предполагает его науглероживание при плавке в дуговых печах [24 – 26]. Поэтому несомненно, что более целесообразным всегда будет прямой электролиз менее прочных оксидов металла.
Выводы
В металлах нет атомов, в рудах нет молекул: и там, и там металлы присутствуют в виде катионов, связанных валентными электронами атомов металлов металлической связью в металлах или ионной связью в оксидах руд. Окисление металлов заключается в потере валентных электронов атомами металлов и возвращении их катионам металлов при восстановлении, то есть окисление и восстановление являются электрохимическими процессами.
Электронная теория восстановления описывает процесс перехода валентных электронов от атомов восстановителя к катионам восстанавливаемого металла. Согласно теории в условиях восстановительных агрегатов газовая фаза находится в состоянии низкотемпературной плазмы, а оксиды руд обладают электрон-анионной проводимостью, благодаря чему для обмена электронами между восстановителями и катионами металлов в рудах даже не требуется физического контакта восстановителей с рудой.
«Свободные» электроны, обеспечивающие металлическую связь восстанавливаемых катионов, в восстановительных условиях возникают на поверхности руд вследствие перехода кислорода в восстановительную газовую фазу в виде атомов. Они компенсируют заряд аниона в образовавшейся анионной вакансии и одинаково взаимодействуют одновременно со всеми ближайшими к вакансии катионами, то есть являются носителями свойств будущей металлической фазы.
В комплексных рудах образовавшиеся на поверхности «свободные» электроны могут перемещаться вместе с анионными вакансиями в кристаллической решетке оксидов до встречи с катионами, обладающими в данных условиях максимальным сродством к электрону, тормозиться у них и в пустоте сливающихся анионных вакансий образовывать металлическую фазу. При этом выход кислорода в газовую фазу из одного оксида может приводить к восстановлению катионов в кристаллической решетке другого оксида.
Восстановительные агрегаты по физической сути работы являются электрохимическими устройствами, в которых последовательно работают два известных электрохимических устройства: топливный элемент, преобразующий химическую энергию восстановителя в электрическую энергию «свободных» электронов, и твердоэлектролитный электролизер, превращающий электрическую энергию этих электронов в энергию металлической связи восстанавливаемых катионов.
Поскольку заключительной стадией любой восстановительной реакции является поглощение «свободных» электронов восстанавливаемыми катионами, то принципиально самым прямым и коротким путем восстановления является получение «свободных» электронов на современных электростанциях и подвод их к катионам из электрической сети, то есть электролиз.
Электролиз расплавов с получением безуглеродного железа является перспективой развития технологий переработки богатых железных моноруд. Многообещающим направлением развития технологий переработки комплексных и бедных руд является селективное восстановление железа при относительно низкой температуре водородом с получением безуглеродного железа и оксидных концентратов более активных металлов (марганца, хрома, титана и др.).
Список литературы
1. Любан А.П. Анализ явлений доменной плавки. Москва: Металлургиздат; 1962:532.
2. Bogdandy L., Engell H.-J. The Reduction of Iron Ores. Scientific Basis and Technology. Berlin; Heidelberg: Springer-Verlag; 1971:576. https://doi.org/10.1007/978-3-662-10400-2
3. Металлургия чугуна / Е.Ф. Вегман, Б.Н. Жеребин, А.Н. Похвистнев и др. Москва: Металлургия; 1989:512.
4. Ghosh A., Chatterjee A. Ironmaking and Steelmaking: Theory and Practice. PHI Learning Pvt. Ltd.; 2008:472.
5. Основы теории и технологии доменной плавки / А.Н. Дмитриев, Н.С. Шумаков, Л.И. Леонтьев, О.П. Онорин. Екатеринбург: УрО РАН; 2005:545.
6. Начала металлургии: учебник для вузов / В.И. Коротич, С.С. Набойченко, А.И. Сотников и др. Екатеринбург: УГТУ; 2000:392.
7. Коновалов Ю.В., Троянский А.А., Тимошенко С.Н. Металлургия: учебное пособие в трех книгах. Книга 1. Производство чугуна, железа, стали и ферросплавов. Донецк: ДонГТУ; 2011:431.
8. Юсфин Ю.С., Пашков Н.Ф. Металлургия железа. Москва: ИКЦ «Академкнига»; 2007: 464.
9. Рощин В.Е., Рощин А.В. Общая электронная теория восстановления (окисления) металлов. Известия вузов. Черная металлургия. 2020;63(3-4):271–285. https://doi.org/10.17073/0368-0797-2020-3-4-271-285
10. Рощин В.Е., Рощин А.В. Физика пирометаллургических процессов. Учебник. Москва; Вологда: Инфра-Инженерия; 2021:304.
11. Пономаренко А.Г. Вопросы термодинамики фаз переменного состава, имеющих коллективную электронную систему. IV. Уровень Ферми в оксидных фазах. Журнал физической химии. 1974;XLVIII(8):1954–1958.
12. Металлургия алюминия. Технология, электроснабжение, автоматизация / Г.В. Галевский, Н.М. Кулагин, М.Я. Миндис, Г.А. Сиразутдинов. Москва: Флинта: Наука; 2017:529.
13. Lopes D.V., Quina M.J., Frade J.R., Kovalevsky A.V. Prospects and challenges of the electrochemical reduction of iron oxides in alkaline media for steel production. Frontiers in Materials. 2022;9:1010156. https://doi.org/10.3389/fmats.2022.1010156
14. Boston Metal: электролиз как чистая альтернатива производству стали. URL: https://econet.ru/articles/boston-metal-elektroliz-kakchistaya-alternativa-proizvodstvu-stali (Дата обращения 10.06.2025).
15. Mehta A. Meet the green technologies set to transform the geopolitics of steelmaking. Available at URL: https://www.reuters.com/sustainability/decarbonizing-industries/meet-green-technologies-set-transform-geopolitics-steelmaking-2025-05-28/. (Accessed 10.06.2025).
16. Humbert M.S., Brooks G.A., Duffy A.R., etc. Economics of electrowinning iron from ore for green steel production. Journal of Sustainable Metallurgy 2024;10:1679–1701. https://doi.org/10.1007/s40831-024-00878-3
17. Павлов В.В. Несообразности металлургии. Екатеринбург: Изд-во УГТУ; 2013:212.
18. Пат. 2826667 C1 РФ МПК C22B5/02 C22B1/00. Получение оксидов активных металлов и концентратов из комплексных и трудно перерабатываемых железосодержащих руд селективным восстановлением элементов / В Е. Рощин, Ю.С. Кузнецов, П.А. Гамов, С.П. Салихов, К.И. Смирнов, Б. Сулеймен, Н. Косдаулетов, Г. Адилов, А. Бильгенов, Е.В. Григорьев. Заявл. 07.03.2024, опубл. 16.09.2024. Бюл. 26.
19. Smirnov K.I., Gamov P.A., Roshchin V.E. Justification of a rational processing scheme for ilmenite concentrate with production of soft iron and titanium dioxide concentrate. CIS Iron and Steel Review. 2025;29:4–10. https://doi.org/10.17580/cisisr.2025.01.01
20. Patisson F., Mirgaux O. Hydrogen ironmaking: How it works. Metals. 2020;10(7):922. https://doi.org/10.3390/met10070922
21. Ma Y., Filho I.R.S., Bai Y., Schenk J., Patisson F., Beck A., van Bokhoven J.A., Willinger M.G., Li K., Xie D., Ponge D., Zaefferer S., Gault B., Mianroodi J.R., Raabe D. Hierarchical nature of hydrogen-based direct reduction of iron oxides. Scripta Materialia. 2022;213:114571. https://doi.org/10.1016/j.scriptamat.2022.114571
22. Cavaliere P. Hydrogen Assisted Direct Reduction of Iron Oxides. Springer Cham; 2002:399. https://doi.org/10.1007/978-3-030-98056-6
23. Lüngen H.B., Schmöle P. The way the European steel industry wants to become carbon neutral. In: Proceedings of 9th European Coke and Ironmaking Congress (ECIC 2024). Coal, Coke, Biocoal, Biocoke, Biochar and Iron Reductions. Italy, Bardolino, 16 – 18 October 2024. Italy: Associazione Italiana di Metallurgia (AIM); 2024:1–12.
24. West K. High-temperature molten oxide electrolysis steelmaking (ULCOLYSIS). Available at URL: https://energy.nl/data/high-temperature-molten-oxide-electrolysis-steelmaking-ulcolysis/ (Accessed 10.06.2025).
25. Electrolysis in ironmaking. Fact sheet. Available at URL: https://worldsteel.org/wp-content/uploads/Fact-sheet-Electrolysis-in-ironmaking.pdf (Accessed 10.06.2025).
26. Primary Exploration of Hydrogen Metallurgy. Zhang J., Li K., Liu Z., Yang T. eds. Springer. Springer: 2024:410.
Об авторах
В. Е. РощинРоссия
Василий Ефимович Рощин, д.т.н., профессор, главный научный сотрудник научно-исследовательской лаборатории «Водородные технологии в металлургии»
Россия, 454080, Челябинск, пр. Ленина, 76
А. В. Рощин
Россия
Антон Васильевич Рощин, д.т.н., доцент, ведущий научный сотрудник научно-исследовательской лаборатории «Водородные технологии в металлургии»
Россия, 454080, Челябинск, пр. Ленина, 76
Рецензия
Для цитирования:
Рощин В.Е., Рощин А.В. Электрохимия восстановительных процессов и перспективы развития восстановительных технологий. Известия высших учебных заведений. Черная Металлургия. 2025;68(4):424-433. https://doi.org/10.17073/0368-0797-2025-4-424-433
For citation:
Roshchin V.E., Roshchin A.V. Electrochemistry of reduction processes and prospects for the development of reduction technologies. Izvestiya. Ferrous Metallurgy. 2025;68(4):424-433. https://doi.org/10.17073/0368-0797-2025-4-424-433
JATS XML