Перейти к:
Термодинамический анализ условий разделения железа и титана в ильменитовом концентрате селективным восстановлением элементов
https://doi.org/10.17073/0368-0797-2025-2-171-178
Аннотация
Методом термодинамического моделирования определены значения температуры начала восстановления железа, ванадия, кремния и титана ильменитового концентрата углеродом или водородом при разном количестве восстановителя в системе. Количество избыточного углерода по отношению к стехиометрии реакции восстановления железа не влияет на температуру начала восстановления элементов, но определяет степень их восстановления и количество образующихся карбидов. Количество водорода в системе существенно влияет на температуру начала восстановления: с увеличением количества водорода температура начала восстановления каждого из элементов снижается, но в разной степени. Более широкий температурный интервал начала восстановления элементов водородом и количественно неодинаковое влияние температуры создают больше возможностей для управления твердофазным селективным восстановлением элементов водородом в сравнении с углеродом. В отличие от карботермического процесса твердофазное восстановление титана водородом ничтожно мало при относительно низких температурах, при которых титан восстанавливается углеродом и образует карбиды. Малая растворимость водорода в твердом железе исключает его влияние на поведение элементов на стадии разделительной плавки продуктов твердофазного восстановления. Это позволяет проводить восстановление в потоке водорода путем изменения температуры и количества водорода в восстановительной газовой смеси, управлять процессами селективного твердофазного восстановления элементов. Использование водорода на стадии твердофазного восстановления позволяет селективно восстанавливать железо с сохранением оксидов титана в оксидной фазе в виде TiO2 , а после разделения продуктов восстановления плавлением получать востребованные продукты (безуглеродистое железо и концентрат оксида титана TiO2 ).
Ключевые слова
Для цитирования:
Смирнов К.И., Гамов П.А., Рощин В.Е., Самолин В.С. Термодинамический анализ условий разделения железа и титана в ильменитовом концентрате селективным восстановлением элементов. Известия высших учебных заведений. Черная Металлургия. 2025;68(2):171-178. https://doi.org/10.17073/0368-0797-2025-2-171-178
For citation:
Smirnov K.I., Gamov P.A., Roshchin V.E., Samolin V.S. Thermodynamic analysis of conditions for iron and titanium separation in ilmenite concentrate by selective reduction of elements. Izvestiya. Ferrous Metallurgy. 2025;68(2):171-178. https://doi.org/10.17073/0368-0797-2025-2-171-178
Введение
В России существует дефицит сырьевых материалов для производства пигментного оксида титана TiO2 и металлического титана. Импорт пигментного оксида титана TiO2 в 2019 г. составил 53,6 тыс. т или 67,5 % его потребления [1]. Производство оксида титана TiO2 осуществляют на предприятии «Крымский титан» (г. Армянск) сернокислотным способом, а металлического титана ‒ с использованием хлоридных технологий на предприятиях «ВСМПО-АВИСМА» (г. Березники) и «Соликамский магниевый завод» (г. Соликамск).
В мире преобладает производство оксида титана TiO2 с использованием хлоридного метода из-за более сильного загрязнения окружающей среды при сернокислотном способе [2]. Однако для получения оксида титана TiO2 и металлического титана хлоридным способом вследствие отсутствия рациональной схемы переработки побочных продуктов хлорирования используют не ильменитовый концентрат, а природные рутиловые концентраты или высокотитанистые шлаки, полученные пирометаллургическим методом по технологии Sorel. Рудотермическая электроплавка (процесс Sorel) является основным способом пирометаллургической переработки ильменитовых концентратов. В результате плавки получают ванадийсодержащий чугун и высокотитанистый шлак. При этом в металлическую фазу переходит 96 ‒ 97 % железа и 45 ‒ 48 % содержащегося в концентрате ванадия. Во время плавки происходит частичное восстановление титана до низших оксидов и даже до металла, при этом переход титана в металлическую фазу может составлять до 2 % [3]. Процесс Sorel требует больших затрат электрической энергии вследствие образования тугоплавкого шлака, поэтому используется только в районах с дешевой электрической энергией [4].
Снижение затрат электрической энергии при переработке ильменитового сырья достигается путем выноса восстановительных процессов в отдельный агрегат для проведения твердофазной металлизации с использованием дешевых видов восстановителей и топлива, а в дуговой печи осуществляется только разделение продуктов металлизации. Оценка использования металлизованной шихты при плавке в рудотермической печи показала, что при степени металлизации около 70 % расход электрической энергии на 1 т высокотитанистого шлака уменьшается примерно на 35 %, а с учетом внесения физического тепла ‒ еще на 20 % [5].
По результатам опробования переработки концентратов из руд Чинейского месторождения предложена технология двухстадийной пирометаллургической переработки с извлечением железа, титана и ванадия [6]. Технология включает предварительное восстановление железа углеродом во вращающейся трубчатой печи с достижением степени металлизации железа 90 – 93 % и разделение горячего металлизованного концентрата в рудотермической печи с получением ванадиевого чугуна и титанистого шлака. Эта технология рекомендована и для других средне- и высокотитанистых концентратов, но пока не нашла промышленного применения.
Альтернативным восстановителем железа при переработке титансодержащих железорудных материалов может быть водород. Теоретически обосновано [7; 8] и экспериментально подтверждено [9 ‒ 11], что водород обладает рядом преимуществ по сравнению с углеродсодержащими восстановителями, что особенно важно при селективном восстановлении металлов из комплексных руд.
Для оценки условий протекания химических реакций в металлургических процессах широко используется термодинамическое моделирование. В большинстве случаев термодинамические расчеты сводятся к анализу протекания химических реакций по изменению энергии Гиббса. Этот метод предполагает выбор наиболее вероятной реакции из всех возможных по значению ∆G(Т). В сложных системах, которыми являются руды и концентраты, такой расчет является трудоемким, а в некоторых случаях невыполнимым из-за большого количества компонентов. Поэтому при расчете сложных систем наиболее рационально использование программных комплексов ЭВМ.
Восстановление элементов из ильменитового концентрата с использованием термодинамического моделирования исследовали в работах [12 ‒ 21]. В работе [12] изучено распределение титана, железа и примесей между металлом и шлаком при восстановлении углеродом в зависимости от температуры в интервале 1550 ‒ 1750 °C и от основности шлака. Авторы работы [13] проанализировали влияние состава газовой смеси CO ‒ H2 в интервале температур 500 ‒ 1200 °C. В работе [14] исследовано протекание карботермического восстановления в вакууме. Как показано в работе [15] образующиеся в результате восстановления водородом низшие оксиды титана при температуре выше 827 °C могут быть использованы для восстановления железа из ильменита. В работе [16] исследованы процессы при варьировании количеств ильменита, углерода и водорода при давлении 0,10132 МПа, а в [17] рассчитано изменение энергии Гиббса для ряда реакций, протекающих при карботермическом восстановлении элементов в ильмените в широком интервале температур (25 ‒ 1650 °C). Работа [18] посвящена карботермическому восстановлению элементов из ильменитового концентрата в вакууме. Авторы работы [19] исследовали протекание реакции восстановления при использовании биомассы из пальмовых косточек в интервале температур 1000 ‒ 1200 °C. В работе [20] изучено влияние соединения Na2CO3 на протекание восстановительной электроплавки. В статье [21] рассматривается протекание реакций при использовании газовых смесей Ar ‒ H2 с различным содержанием водорода в интервале температур 800 ‒ 1000 °C. Однако следует отметить, что работы по сравнительному анализу условий восстановления элементов из ильменитового концентрата углеродом и водородом в литературе отсутствуют.
Целью настоящей работы является сравнение методом термодинамического моделирования условий восстановления элементов в ильменитовом концентрате углеродом или водородом.
Методика проведения исследований
При проведении термодинамических расчетов использовали ильменитовый концентрат следующего состава, мас. %: O 42,6; Mg 0,4; Al 0,3; Si 0,7; Ti 24,0; V 0,3; Mn 0,4; Fe 31,3.
Равновесный состав компонентов системы и температурную последовательность преобразований компонентов системы при восстановлении углеродом или водородом определяли термодинамическим моделированием с использованием программного комплекса Tерра [22]. При проведении термодинамического расчета использовали базу данных ИКС Tерра, дополненную термодинамическими характеристиками индивидуальных веществ из справочников [23 ‒ 25]. В расчетах количество восстановителя принимали равным необходимому по стехиометрии для восстановления железа или с избытком, который составлял для углерода 10, 20, 30 и 100 мас. %, а для водорода в 10, 100 и 1000 раз превышал стехиометрическое количество. Общее давление в системе принимали неизменным – 0,10132 МПа. Равновесные составы рассчитывали для интервала температур 750 ‒ 1700 °C с шагом 50 °C для восстановления углеродом и 500 ‒ 1700 °C для восстановления водородом. Полученные расчетные данные равновесных составов заносили в таблицу и условно разделяли на три фазы: металл (железо, титан, ванадий и кремний, включая карбиды и силициды), шлак (оксиды) и газ. Данные о степени металлизации, составе металла, шлака и газовой фазы анализировали и для удобства представляли в виде графических зависимостей.
Результаты расчета и их обсуждение
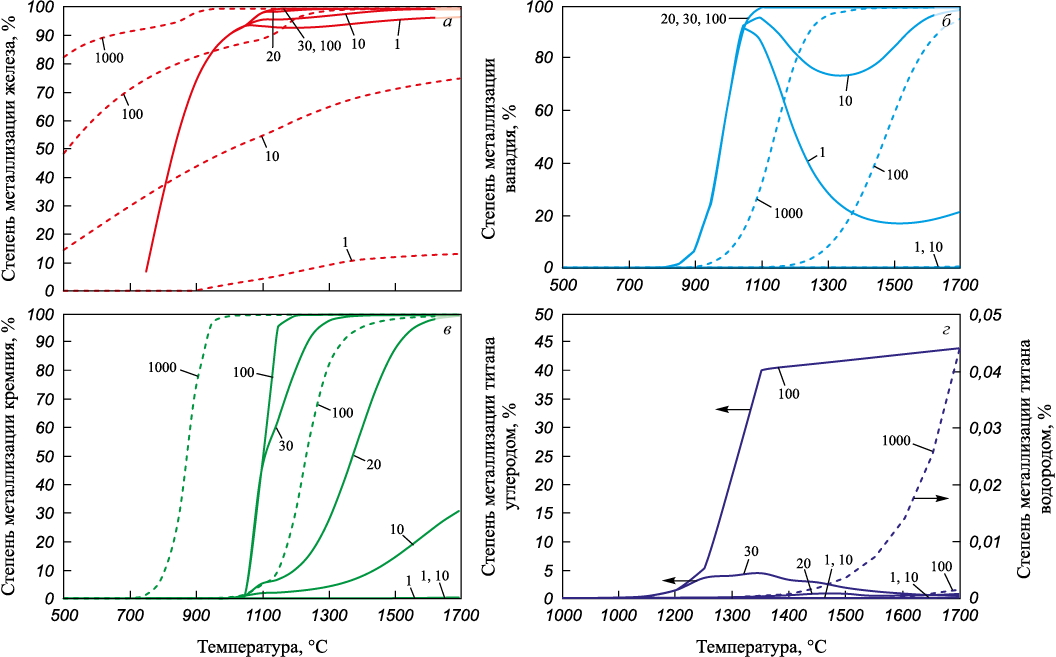
По результатам термодинамического моделирования восстановления элементов из ильменитового концентрата углеродом или водородом можно выделить несколько элементов, активно участвующих в процессе восстановления с образованием металлической фазы (железа, титана, ванадия и кремния) (см. рисунок).
Влияние количества восстановителей на степень металлизации железа (а), |
Наиболее легко восстанавливаемым элементом в ильменитовом концентрате является железо. Восстановление железа и углеродом, и водородом наблюдается в интервале всех исследуемых значений температуры и количеств восстановителя за исключением восстановления водородом при его стехиометрическом количестве. До температуры 1050 °C степень металлизации железа углеродом растет независимо от количества восстановителя в системе. При температуре выше 1050 °C степень металлизации продолжает увеличиваться, но уже с разной интенсивностью в зависимости от избытка углерода.
Увеличение количества водорода в системе способствует увеличению степени металлизации железа. Максимальная степень металлизации железа углеродом составляет 99,39 % в интервале температур 1250 – 1700 °C при избытке восстановителя 100 % от стехиометрического значения, а водородом ‒ 99,36 % при температуре 1700 °C и тысячекратном избытке водорода. В обоих случаях полного восстановления не достигается вследствие образования комплексного оксида FeAl2O4 . Железо в металле при восстановлении углеродом содержится в основном в виде карбида Fe3C, а при восстановлении водородом ‒ в виде отдельного компонента. Восстановленный кремний связывает часть железа в силициды FeSi и Fe3Si в системе с углеродом при температуре выше 1050 °C, а в системе с водородом – при температуре выше 750 и 1200 °C.
Восстановление ванадия углеродом наблюдается во всем исследуемом температурном интервале, а водородом ‒ при 750 – 1700 °C. В интервале температур 800 – 1050 °C при восстановлении углеродом наблюдается рост равновесной степени металлизации ванадия с образованием карбида ванадия (VC) в металле. В расчетах со стехиометрическим количеством или избытком (10 мас. %) углерода наблюдается снижение степени металлизации ванадия при температурах выше 1050 °C с последующим ростом выше температуры 1500 °C для стехиометрического количества и выше 1350 °C для избытка 10 мас. %. Такое поведение ванадия обусловлено образованием карбидов не только ванадия, но и кремния. Степень металлизации ванадия с избытком углерода 20, 30 и 100 % стехиометрического количества растет с повышением температуры до 1100 °C, при которой достигает 100 %. При восстановлении водородом увеличение его количества в системе способствует снижению температуры начала перехода ванадия в металлическую фазу. Для стехиометрического количества, избытка водорода в 10 и 100 раз температуры, при которых ванадий появляется в металлической фазе, составляют 1450, 1200 и 950 °C. Максимальная равновесная степень металлизации ванадия наблюдается при температурах 1650, 1700 °C и составляет 99,99 %.
Восстановление кремния углеродом наблюдается в интервале температуры 1000 – 1700 °C. Степень металлизации кремния углеродом при 1000 и 1050 °C не зависит от количества восстановителя. При температуре выше 1050 °C степень металлизации кремния растет с увеличением температуры и количества углерода. Максимальная степень металлизации кремния наблюдается при 1700 °C и составляет для стехиометрического количества и избытка углерода 10, 20, 30 и 100 мас. % соответственно 30,83, 99,52, 99,9, 99,95 и 100 %.
Восстановление кремния водородом при его тысячекратном избытке наблюдается в интервале температур 650 ‒ 1700 °C. С увеличением количества водорода в системе температура перехода кремния в металлическую фазу снижается до 1250 и 900 °C для избытка стехиометрического количества в 10 и 100 раз. При стехиометрическом количестве водорода кремний в системе не восстанавливается. В интервале температур 1350 ‒ 1700 °C максимальная (100 %) степень металлизации кремния наблюдается при тысячекратном избытке водорода от стехиометрического количества. Кремний в металлической фазе в обоих случаях содержится в основном в виде силицидов железа FeSi и Fe3Si.
Восстановление титана углеродом происходит при температуре 1050 °C и выше, водородом ‒ выше 1550 °C и только в случае тысячекратного избытка восстановителя. При избытке углерода менее 10 мас. % степень металлизации титана близка к нулю и составляет 0,02 % при температуре 1100 °C. При избытке углерода 20, 30 и 100 мас. % от стехиометрического значения максимальная равновесная степень металлизации титана составляет 0,77, 4,37 и 44,02 % при 1450, 1350 и 1700 °C соответственно.
Твердофазное восстановление титана водородом при стехиометрическом количестве и избытке менее стократного невозможно. Максимальная степень металлизации титана составляет 0,05 % при 1700 °C и избытке водорода, в 1000 раз превышающем стехиометрическое количество. При восстановлении углеродом титан присутствует в металлической фазе в виде карбида TiC, а при восстановлении водородом – в растворе с железом.
Селективное восстановление железа из ильменита возможно углеродом и водородом. Для эффективного разделения присутствующих в ильменитовом концентрате элементов необходимы достижение высокой степени твердофазной металлизации железа, отсутствие металлизации титана и исключение возможности восстановления титана при разделительной плавке продуктов твердофазной металлизации. В условиях, при которых достигается высокая степень твердофазной металлизации железа, возможно восстановление и других компонентов ильменитового концентрата (ванадия, кремния, титана). Восстановление титана в рассматриваемом случае крайне нежелательно. Ванадий как один из ценных элементов ильменитового концентрата может при дальнейшем переделе извлекаться из металла и шлака. Однако существующая технология извлечения ванадия из металла сопровождается его существенными потерями на всех стадиях передела, что уменьшает его сквозное извлечение из руды. Кремний в концентрате присутствует в пустой породе, его извлечение в металл не представляет практического интереса по причине малого содержания.
Результаты расчетов показали, что восстановление железа в ильмените водородом происходит при более низкой температуре, чем при восстановлении углеродом, а степень металлизации существенно зависит от количества водорода в системе. Температура начала восстановления железа водородом при стехиометрическом количестве водорода составляет 900 °C, а при избытке в 10, 100 и 1000 раз, превышающем стехиометрическое количество, – при температуре менее 500 °C, тогда как температура начала восстановления железа углеродом одинакова (примерно 700 °C).
Титан водородом практически не восстанавливается даже при избытке водорода, в тысячу раз превышающем стехиометрию на восстановление железа. В присутствии углерода в системе титан образует устойчивое соединение TiС, что способствует относительно высокой степени его металлизации, однако при недостатке в системе углерода в первую очередь он расходуется на восстановление других элементов.
Ванадий в присутствии углерода в системе ведет себя аналогично титану, однако его восстановление из оксида как элемента, обладающего меньшим сродством к кислороду по сравнению с титаном, происходит при относительно низкой температуре, сопоставимой с температурой восстановления железа. Восстановление ванадия водородом существенно зависит от его количества. При стехиометрическом количестве водорода, а также при его десятикратном избытке ванадий почти не восстанавливается, а при избытке в 100 и 1000 раз степень металлизации достигает достаточно высоких значений (около 100 % при температурах 1700 и 1400 °C). Необходимо обратить внимание, что восстановление ванадия водородом происходит при более высоких температурах по сравнению с восстановлением углеродом.
Кремний в отличие от титана и ванадия образует силициды железа, степень его восстановления существенно зависит от восстановительной способности восстановителя. Восстановление кремния углеродом при наличии его избытка начинается при температуре 1000 °C, однако восстановление водородом зависит от парциального давления кислорода в системе. При большом избытке водорода (в 100 и 1000 раз превышающем стехиометрическое количество на восстановление железа) температура, при которой кремний появляется в металлической фазе, составляет 950 и 750 °C.
Следует отметить, что температура перехода элементов в металлическую фазу при восстановлении элементов углеродом не зависит от его количества в системе. Количество углерода в системе определяет полноту протекания реакций восстановления. Температуры Тн.в. начала восстановления элементов водородом существенно зависят от отношения H2O/H2 в системе, для исследуемой системы значения равновесного отношения H2O/H2 приведены в таблице.
Температуры появления элементов в металлической фазе
|
Выводы
Температуры появления в металлической фазе железа, ванадия, кремния и титана в ильменитовом концентрате составляют 700, 800, 1000 и 1150 °С соответственно и не зависят от количества углерода в системе. Количество избыточного углерода по отношению к стехиометрии реакции восстановления железа определяет степень восстановления ванадия, кремния и титана при повышении температуры системы выше температуры начала восстановления соответствующего элемента. Путем изменения количества углерода в системе и температуры процесса можно управлять развитием реакций восстановления и обеспечить твердофазное селективное восстановление железа или совместное восстановление железа, кремния и ванадия при сохранении титана в оксидной фазе.
Наличие в системе избыточного по отношению к стехиометрии реакции восстановления железа количества углерода приводит к образованию карбидов железа, ванадия и кремния, углерод которых при повышении температуры на стадии пирометаллургического разделения продуктов частично восстанавливает и связывает титан в карбиды, что снижает эффективность разделения железа и титана.
Температуры начала восстановления железа, ванадия, кремния и титана в ильменитовом концентрате водородом находятся в более широком интервале и существенно зависят от количества водорода в системе. С увеличением количества водорода температура начала восстановления каждого из элементов снижается, но в разной степени. Более широкий температурный интервал начала восстановления водородом и количественно неодинаковое влияние температуры создают больше возможностей для управления твердофазным селективным восстановлением элементов водородом в сравнении с углеродом.
Ничтожно малая растворимость водорода в твердом железе исключает его влияние на восстановление элементов на стадии разделительной плавки продукта твердофазного восстановления. Это позволяет вести процесс селективного твердофазного восстановления элементов в потоке водорода, изменением температуры управлять селективными реакциями восстановления без опасения восстановления титана и потери оксида титана TiO2 на стадии разделительной плавки.
Список литературы
1. Леонтьев Л.И., Волков А.И. Состояние и развитие минерально-сырьевой базы и продукции металлургии для обеспечения импортонезависимости России. В кн.: Международная научная конференция «Физикохимические основы металлургических процессов» имени академика А.М. Самарина. Выкса. 10–14 октября 2022 г. Выкса; 2022:18–36.
2. Богатырева Е.В. Производство тугоплавких редких металлов: металлургия титана и его соединений. Москва: Изд. Дом НИТУ «МИСИС»; 2019:161.
3. Денисов С.И. Электротермия титановых шлаков. Москва: Металлургия; 1979:165.
4. Алексеев Л.Ф., Ченцов А.В., Шаврин С.В. Металлургическая оценка уральских ильменитовых концентратов. В кн.: Комплексная переработка металлургического сырья. Препринт. Екатеринбург: УрО РАН; 1994:27–35.
5. Электрометаллургия и химия титана / В.А. Резниченко, В.С. Устинов, И.А. Карязин, А.Н. Петрунько. Москва: Наука; 1982:278.
6. Резниченко В.А., Соловьев В.И., Бурмистрова Т.М. Металлургическая оценка титаномагнетитового концентрата Чинейского месторождения. Комплексное использование минерального сырья. 1986;(2):60–63.
7. Рощин В.Е., Гамов П.А., Рощин А.В., Салихов С.П. Перспективы освоения водородных технологий в отечественной металлургии. Черная металлургия. Бюллетень научно-технической и экономической информации. 2023;79(2):144–153. https://doi.org/10.32339/0135-5910-2023-2-144-153
8. Рощин В.Е., Смирнов К.И., Гамов П.А., Рощин А.В. Фундаментальные особенности водородного восстановления металлов и целесообразность использования водорода на современном этапе. В кн.: Инновации и комплексная переработка минерального сырья – актуальные составляющие диверсификации экономики. Материалы Международной научно-практической конференции. Алматы; 2023:153–155.
9. Гамов П.А., Смирнов К.И., Рощин В.Е., Вяткин Г.П. Оценка возможности селективного извлечения металлов из многокомпонентных оксидных материалов с применением водорода. Черная металлургия. Бюллетень научно-технической и экономической информации. 2024;80(7):47–53. https://doi.org/10.32339/0135-5910-2024-7-47-53
10. Косдаулетов Н.Ы., Рощин А.В., Рощин В.Е. Получение высокомарганцевого шлака путем восстановления железа и фосфора из железомарганцевых руд водородом. Черные металлы. 2024;(2):4–9. https://doi.org/10.17580/chm.2024.02.01
11. Смирнов К.И., Гамов П.А., Самолин В.С., Рощин В.Е. Селективное восстановление железа из ильменитового концентрата. Черные металлы. 2024;(7):19‒23. https://doi.org/10.17580/chm.2024.07.03
12. Moosavi-Khoonsari E., Siahboumi A.A., Kwon S.Y., Jones R., Mostaghel S. Thermodynamic modeling of ilmenite smelting and impurity distribution. JOM. 2024;76: 6511–6533. https://doi.org/10.1007/s11837-024-06844-4
13. Xiao W., Lu X.-G., Zou X.-L., Li C.-H., Ding W.-Z. Multiple gaseous reduction of ilmenite: Thermodynamic and experimental study. Rare Metals. 2015;34:888–894. https://doi.org/10.1007/s12598-014-0264-9
14. Run H., Pengsheng L., Yuehui Y., Jinzhu Z. Vacuum carbothermic reduction of Panzhihua ilmenite concentrate: A thermodynamic study. Mineral Processing and Extractive Metallurgy Review. 2017;38(3):193–198. https://doi.org/10.1080/08827508.2017.1281129
15. Yu H., Li C., Wei K., Li Y., Ma W. Effect of titanium suboxides on the reaction mechanism of hydrogen-reduced ilmenite. International Journal of Hydrogen Energy. 2023; 48(5):1747‒1757. https://doi.org/10.1016/j.ijhydene.2022.10.071
16. Yunos N.F.M., Idris M.A., Nasrun N.A., Kurniawan A., Nomura T., Rezan S.A. Structural characterizations and phase transition on the reducibility of ilmenite ore with different carbon reductants by carbothermal reduction under hydrogen atmosphere. Journal of Sustainable Metallurgy. 2023;9:1716–1731. https://doi.org/10.1007/s40831-023-00760-8
17. He C., Zheng C., Dai W., Fujita T., Zhao J., Ma S., Li X., Wei Y., Yang J., Wei Z. Purification and phase evolution mechanism of titanium oxycarbide (TiCxOy) produced by the thermal reduction of ilmenite. Minerals. 2021;11(2):104. https://doi.org/10.3390/min11020104
18. Zhang G., Gou H., Wu K., Chou K. Carbothermic reduction of Panzhihua ilmenite in vacuum. Vacuum. 2017;143:199‒208. https://doi.org/10.1016/j.vacuum.2017.06.016
19. Setiawan A., Rhamdhani M.A., Pownceby M.I., Webster N.A.S., Harjanto S. Kinetics and mechanisms of carbothermic reduction of weathered ilmenite using palm kernel shell biomass. Journal of Sustainable Metallurgy. 2021;7(4): 1819–1837. https://doi.org/10.1007/s40831-021-00457-w
20. Myrzakulov M.K., Jumankulova S.K., Barmenshinova M.B., Martyushev N.V., Skeeba V.Y., Kondratiev V.V., Karlina A.I. Thermodynamic and technological studies of the electric smelting of Satpaevsk ilmenite concentrates. Metals. 2024;14(11):1211. https://doi.org/10.3390/met14111211
21. Wang Y., Yuan Z., Matsuura H., Tsukihashi F. Reduction extraction kinetics of titania and iron from an ilmenite by H2–Ar gas mixtures. ISIJ international. 2009;49(2):164‒170. https://doi.org/10.2355/isijinternational.49.164
22. Белов Г.В., Трусов Б.Г. Термодинамическое моделирование химически реагирующих систем. Москва: изд. МГТУ имени Н.Э. Баумана; 2013:96.
23. Термодинамические свойства индивидуальных веществ. Справочник. В 2 т. / Л.В. Гурвич, Г.А. Хачкурузов, В.А. Медведев и др. Москва: АН СССР; 1962.
24. Термодинамические свойства индивидуальных веществ. Справочное изд. В 4 т. / Л.В. Гурвич, И.В. Вейц, В.А. Медведев и др. Москва: Наука; 1978–1982.
25. JANAF Thermochemical Tables. NSRDS – NBS37. Washington: Gove Printing Office; 1971:1144.
Об авторах
К. И. СмирновРоссия
Константин Игоревич Смирнов, научный сотрудник научно-исследовательской лаборатории «Водородные технологии в металлургии»
Россия, 454080, Челябинск, пр. Ленина, 76
П. А. Гамов
Россия
Павел Александрович Гамов, к.т.н., доцент, заведующий научно-исследовательской лаборатории «Водородные технологии в металлургии»
Россия, 454080, Челябинск, пр. Ленина, 76
В. Е. Рощин
Россия
Василий Ефимович Рощин, д.т.н., профессор, главный научный сотрудник научно-исследовательской лаборатории «Водородные технологии в металлургии»
Россия, 454080, Челябинск, пр. Ленина, 76
В. С. Самолин
Россия
Владислав Сергеевич Самолин, аспирант кафедры «Пирометаллургические и литейные технологии»
Россия, 454080, Челябинск, пр. Ленина, 76
Рецензия
Для цитирования:
Смирнов К.И., Гамов П.А., Рощин В.Е., Самолин В.С. Термодинамический анализ условий разделения железа и титана в ильменитовом концентрате селективным восстановлением элементов. Известия высших учебных заведений. Черная Металлургия. 2025;68(2):171-178. https://doi.org/10.17073/0368-0797-2025-2-171-178
For citation:
Smirnov K.I., Gamov P.A., Roshchin V.E., Samolin V.S. Thermodynamic analysis of conditions for iron and titanium separation in ilmenite concentrate by selective reduction of elements. Izvestiya. Ferrous Metallurgy. 2025;68(2):171-178. https://doi.org/10.17073/0368-0797-2025-2-171-178