Перейти к:
Молекулярно-динамическое исследование влияния примеси углерода на процесс кристаллизации наночастиц аустенита при быстром охлаждении
https://doi.org/10.17073/0368-0797-2024-4-440-448
Аннотация
Методом молекулярной динамики проведено исследование формирования структуры при кристаллизации наночастиц аустенита в условиях наличия примеси углерода. Рассматривалось влияние скорости охлаждения расплава, размера частиц, концентрации атомов углерода в частице на особенности образующейся структуры при кристаллизации и температуру начала кристаллизации. Показано, что формированием нанокристаллической структуры наночастиц можно управлять путем варьирования скорости охлаждения и введения примеси углерода: при скорости охлаждения выше 1013 К/с в используемой модели кристаллизация не успевала произойти, при скорости ниже 5·1012 К/с частица аустенита кристаллизовалась с образованием нанокристаллической структуры. При этом при снижении скорости охлаждения наблюдалось уменьшение плотности дефектов в конечной структуре. При скорости 5·1011 К/с и менее кристаллизация частиц без углерода проходила с образованием низкоэнергетических границ зерен (с высокой плотностью сопряженных узлов: специальных границ, двойников). Температура кристаллизации при охлаждении со скоростью ниже 1012 К/с обратно пропорциональна диаметру частицы: по мере уменьшения размера частицы увеличивается доля свободной поверхности, что приводит к уменьшению вероятности образования кристаллических зародышей. Кроме того, температура кристаллизации увеличивается при уменьшении скорости охлаждения. Введение примеси углерода приводило к снижению температуры кристаллизации наночастиц: при наличии 10 ат. % углерода она уменьшалась примерно на 200 К для частиц разного размера. Атомы углерода часто образовывали скопления, состоящие из нескольких атомов углерода. Такие скопления искажали образующуюся кристаллическую решетку металла вокруг себя, препятствуя кристаллизации. В условиях наличия примеси углерода конечная структура кристаллизовавшихся частиц имела более высокую плотность границ зерен и других дефектов. Атомы углерода, особенно скопления из них, закреплялись преимущественно на границах зерен и тройных стыках.
Для цитирования:
Зоря И.В., Полетаев Г.М., Бебихов Ю.В., Семенов А.С. Молекулярно-динамическое исследование влияния примеси углерода на процесс кристаллизации наночастиц аустенита при быстром охлаждении. Известия высших учебных заведений. Черная Металлургия. 2024;67(4):440-448. https://doi.org/10.17073/0368-0797-2024-4-440-448
For citation:
Zorya I.V., Poletaev G.M., Bebikhov Yu.V., Semenov A.S. Molecular dynamics study of the influence of carbon impurity on austenite nanoparticles crystallization during rapid cooling. Izvestiya. Ferrous Metallurgy. 2024;67(4):440-448. https://doi.org/10.17073/0368-0797-2024-4-440-448
Введение
Металлические наночастицы имеют уникальный набор физических, химических и оптических свойств. Благодаря этим свойствам наночастицы имеют высокие перспективы применения в таких областях, как микроэлектроника, оптоэлектроника и плазмоника [1; 2], медицина и биология [3; 4], химический катализ, изготовление газовых сенсоров [5; 6]. При изготовлении наночастиц большое внимание уделяется управлению фазовым состоянием, размером и формой частиц из-за их критического влияния на полезные свойства [7 ‒ 10]. Ввиду этого большое значение приобретает исследование факторов, влияющих на механизмы и кинетику фазовых переходов, а также на конечную структуру частиц. Большой интерес в последнее время представляют частицы с высоким уровнем беспорядка атомной структуры: аморфной или нанокристаллической [11 ‒ 14]. Такие частицы обладают высокой запасенной энергией, имеют уникальную электронную структуру. Это делает перспективным применение таких частиц в областях катализа, биомедицины, оптики и электроники [15 ‒ 17].
Нанокристаллическую структуру, то есть поликристаллическую структуру со сравнительно малым размером зерен (от нескольких нанометров до нескольких десятков нанометров) с высокой плотностью неравновесных границ зерен, можно получать не только путем интенсивной деформации, но и при достаточно быстром охлаждении, когда в процессе роста зерен рекристаллизация подавляется и образуется множество мелких зерен [18; 19]. С помощью компьютерного моделирования в работах [20 ‒ 23], например, было показано, что наночастицы чистых металлов при охлаждении со скоростью порядка 1012 К/с от расплавленного состояния кристаллизуются с образованием нанокристаллической структуры с высокой плотностью границ зерен и средним размером зерен всего около нескольких нанометров. В работах [20; 22; 23] показано, что при скорости охлаждения более 1013 К/с гомогенная кристаллизация уже не успевала произойти и охлажденные в молекулярно-динамической модели частицы имели аморфную структуру.
Большой научный и технологический интерес имеет взаимодействие примесных атомов легких элементов с металлами. Атомы углерода, азота, кислорода даже при небольших концентрациях существенно влияют на свойства металлов. Несмотря на важность понимания механизмов и процессов, лежащих в основе влияния легирования примесями легких элементов на свойства металлов, в настоящее время остается много вопросов, касающихся поведения примесей на атомном уровне в металлической матрице. Одним из таких вопросов является определение влияния примесей на фазовые переходы, в частности, поиск путей управления температурными интервалами существования фаз в металлических наноматериалах путем варьирования примесей. Настоящая работа посвящена изучению на атомном уровне с помощью метода молекулярной динамики процесса кристаллизации наночастиц аустенита и влияния на данные процессы примеси углерода.
Описание модели
Для описания взаимодействий Fe – Fe в аустените использовался ЕАМ потенциал Лау [24], хорошо воспроизводящий структурные, энергетические и упругие характеристики аустенита [24; 25]. Для описания взаимодействий атомов железа с атомами углерода и атомов углерода друг с другом в матрице металла использовались потенциалы Морзе [26], найденные с учетом экспериментальных данных по энергии растворения и энергии миграции примесных атомов углерода в кристалле аустенита, радиусу атомов, их электроотрицательности, энергии взаимной связи и другим характеристикам.
Круглая частица аустенита в модели на первом этапе создавалась путем вырезания шара соответствующего размера из идеального ГЦК кристалла. Рассматривались частицы диаметром от 1,5 до 12,0 нм. Частица находилась в расчетной ячейке в виде прямоугольного параллелепипеда с периодическими граничными условиями. Для данной модели могут быть использованы и свободные условия (то есть отсутствие каких-либо граничных условий), но в настоящей работе использованы периодические, чтобы атомы, испаряющиеся при больших температурах с поверхности частицы, не улетали на большое расстояние от частицы, а оставались в расчетной ячейке. Расстояние между стенками расчетной ячейки достаточно большое, чтобы исключить взаимодействие частицы со своим виртуальным двойником [27; 28].
Примесные атомы углерода вводились случайно по всему объему металлической частицы. Концентрация примесей варьировалась от 0 до 10 aт. %. После создания начальной круглой частицы проводилась структурная релаксация, в течение которой устанавливалось равновесное состояние атомной структуры. Контроль температуры осуществлялся с помощью термостата Нозе-Гувера. Температура в модели задавалась через изменение скоростей атомов. Шаг интегрирования по времени в методе молекулярной динамики был равен 1 фс.
Полученные частицы использовались как стартовые для моделирования постепенного нагревания и последующего охлаждения частиц. Для частиц каждого размера проводилось моделирование нагревания с постоянной скоростью от монокристаллического состояния до температуры, значительно превышающей температуру плавления (от 600 до 2000 К для больших частиц и, как правило, до 1800 К для относительно малых) и обратное охлаждение от температуры расплава до 600 К (для моделирования кристаллизации). Изменение температуры при нагревании и охлаждении осуществлялось с постоянной скоростью путем соответствующего изменения модулей скоростей всех атомов в модели. Известно, что при охлаждении расплавов со скоростью выше 1013 ‒ 1014 К/с гомогенная кристаллизация не успевает произойти даже в чистых металлах и в таком случае получаются металлические стекла [29; 30]. В то же время скорости 1012 К/с, как было показано в работах [20 ‒ 23] и будет показано ниже, достаточно для протекания кристаллизации.
Результаты и обсуждение
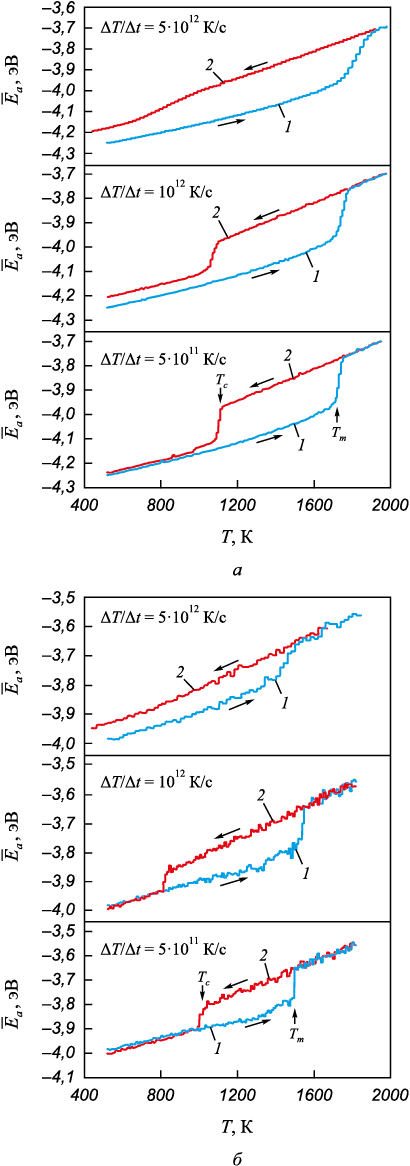
В качестве основной характеристики состояния структуры наночастиц была выбрана средняя потенциальная энергия атома. На рис. 1 показаны зависимости средней энергии атома от температуры для частиц диаметром 8,0 и 2,5 нм при нагреве от монокристаллического состояния и обратном охлаждении от расплава с разными скоростями изменения температуры: 5·1011, 1012 и 5·1012 K/с. Резкие изменения средней энергии атома на графиках, очевидно, соответствуют фазовым переходам: при подъеме – плавлению, при падении ‒ кристаллизации. Фазовые переходы плавление – кристаллизация, как известно, происходят не мгновенно, фронт кристалл – жидкость движется с конечной скоростью, зависящей от температуры и, как правило, составляющей несколько десятков метров в секунду [31; 32]. Наличия неподвижного фронта кристалл – жидкость не наблюдалось; образовавшись, такой фронт обычно двигался до тех пор, пока не происходило плавления или кристаллизации всей частицы. В связи с вышесказанным определяли температуры фазовых переходов по моменту их начала (показаны стрелками на рис. 1).
Рис. 1. Зависимости средней потенциальной энергии атома |
Кристаллизация при постепенном охлаждении от расплава происходила при температуре, существенно ниже температуры плавления. Такое большое отличие температур Tm и Tc наночастиц – известное явление в моделировании [20; 22; 33]. Процесс кристаллизации, как можно видеть, более чувствителен к скорости изменения температуры, чем плавление: для всех трех скоростей начало плавления примерно совпадает, тогда как температуры начала кристаллизации явно отличаются, причем при скорости 5·1012 К/c кристаллизация происходит (рис. 1, а) лишь частично для частицы диаметром 8,0 нм (это видно по сравнительно небольшому падению средней энергии атомов) и не наступает для частицы диаметром 2,5 нм. Гомогенная кристаллизация, как известно, состоит из двух этапов: зарождение кристаллических зародышей и их рост, то есть движение фронта кристаллизации. Эти этапы последовательные, и после образования устойчивых зародышей движение фронта осуществляется примерно с той же скоростью, что и при плавлении, что видно по похожему наклону графиков в большинстве случаев при плавлении и кристаллизации.
Следует заметить, что для частицы диаметром 8,0 нм после кристаллизации средняя энергия атома больше, чем в начальной монокристаллической частице (рис. 1, а, зависимость 2), причем, чем выше скорость охлаждения, тем больше эта разница. Это объясняется образованием после кристаллизации нанокристаллической структуры, для которой характерны более высокие значения средней энергии атома по сравнению с монокристаллической частицей из-за наличия границ зерен и других дефектов. Чем выше скорость охлаждения, тем меньше времени затрачивается на релаксацию структуры и тем выше плотность дефектов в охлажденной частице.
При уменьшении диаметра частицы зависимости средней энергии атома от температуры претерпевали качественные изменения. В первую очередь, заметно меньшее отличие энергий для кристаллического и аморфного состояний по сравнению с частицами большего размера (рис. 1, б). Очевидно, это связано с относительно более высокой долей поверхностных атомов в данном случае. Кроме того, для малых частиц выше колебания значений энергии и выше погрешность определения температур фазовых переходов, что обусловлено сравнительно меньшим количеством атомов в них.
Еще одним важным изменением графиков при уменьшении размера частиц являлось снижение значений температур плавления и кристаллизации, а также более сильное влияние скорости охлаждения на температуру кристаллизации. Очевидно, это является следствием более высокой доли поверхностных атомов при уменьшении диаметра частиц. При скорости 5·1012 К/с кристаллизация частиц диаметром менее 3 нм не произошла: это видно по отсутствию скачка энергии вниз, соответствующего кристаллизации (например, рис. 1, б, зависимость 2).
На рис. 2 изображена атомная структура в разрезе частиц диаметром 8,0 нм, полученная с помощью визуализатора кристаллических фаз. Данный визуализатор определяет принадлежность каждого атома к той или иной кристаллической структуре путем анализа расположения соседних атомов [34]. На рис. 2 хорошо видно, что с ростом скорости охлаждения размеры зерен уменьшаются, а количество структурных несовершенств, в том числе границ зерен, увеличивается. При скорости охлаждения 5·1011 К/с, судя по очень близкому расположению зависимостей 1 и 2 на рис. 1, то есть незначительному отличию средней энергии монокристаллической и закристаллизовавшейся частиц, кристаллизация, по всей видимости, проходила зачастую с образованием низкоэнергетических границ зерен (с высокой плотностью сопряженных узлов: специальных границ, двойников).
Рис. 2. Атомная структура частиц аустенита диаметром 8,0 нм, |
Для математического описания влияния свободной поверхности наночастиц на их температуру плавления часто используют формулу, основанную на предположении, что изменение температуры фазового перехода пропорционально отношению площади поверхности к объему частицы [35 ‒ 37], то есть для круглой частицы это изменение должно быть пропорционально N \(^{–1/3}\) или d \(^{–1}\) (где N – количество атомов в частице; d – диаметр частицы). В настоящей работе использовано предположение для температуры кристаллизации, добавлена поправка δ, учитывающая конечную толщину приповерхностного слоя частицы:
| \[{T_c}(d) = T_c^0\left( {1 - \frac{{{\alpha _c}}}{{d - \delta }}} \right),\] | (1) |
где Tc и \(T_c^0\) – температуры кристаллизации частицы и массивного материала; αc – параметр, отвечающий за степень влияния поверхности частицы на ее кристаллизацию.
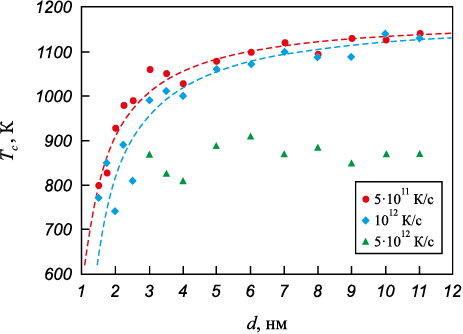
Формула (1) использована для построения аппроксимационной кривой зависимости температуры кристаллизации наночастиц от их диаметра (штриховые линии на рис. 3). Как можно видеть, для скоростей охлаждения 1012 и 5·1011 К/с полученные в модели значения (показаны маркерами на рис. 4) достаточно хорошо совпадают с аппроксимационными кривыми, что подтверждает ведущую роль свободной поверхности не только в процессе плавления, но и кристаллизации наночастиц. Значения величин для расчета по формуле (1): \(T_c^0\) = 1190 К, αc = 0,38 К·нм, δ = 0,4 нм для скорости 5·1011 К/с и \(T_c^0\) = 1190 К, αc = 0,49 К·нм, δ = 0,4 нм для скорости 1012 К/с.
Рис. 3. Температура кристаллизации частицы аустенита |
Как можно видеть по зависимостям на рис. 3, при уменьшении скорости охлаждения температура кристаллизации увеличивается. Этот факт является подтверждением того, что образование очагов кристаллизации является вероятностным процессом, требующим сравнительно продолжительного времени для формирования устойчивых зародышей. При скорости охлаждения 5·1012 К/с частицы диаметром менее 3 нм не кристаллизовались (треугольные маркеры на рис. 3). Погрешность определения начала кристаллизации при данной скорости была больше, чем при других рассмотренных скоростях. Тем не менее хорошо видно, что при наибольшей из рассмотренных скоростей 5·1012 К/с кристаллизация наступает при меньших температурах, чем при более низких скоростях.
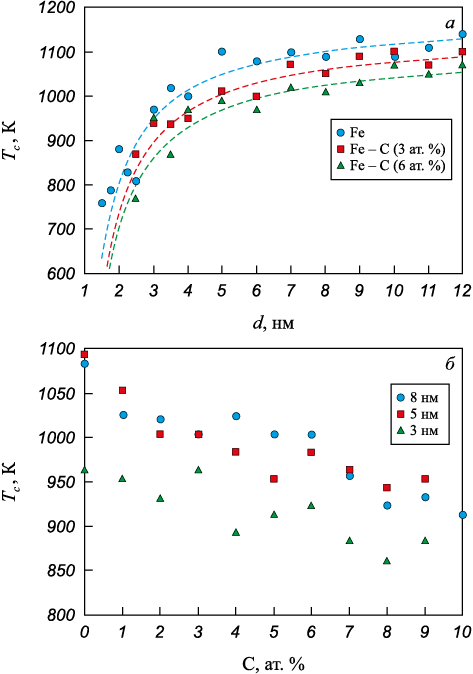
Рис. 4. Зависимости температуры кристаллизации частицы |
Введение примеси углерода приводило к снижению температуры кристаллизации. На рис. 4 изображены зависимости температуры кристаллизации от диаметра частицы (рис. 4, а) и от концентрации примеси углерода (рис. 4, б). Были получены следующие значения величин для расчета по формуле (1): \(T_c^0\) = 1155 К, αc = 0,57 К·нм для концентрации 3 ат. %; \(T_c^0\) = 1120 К, αc = 0,59 К·нм для концентрации 6 ат. %. Величина δ, имеющая смысл ширины поверхностного слоя, во всех случаях оказалась одинаковой ‒ 0,4 нм.
С ростом концентрации углерода в рассматриваемом диапазоне концентрации примесных атомов температура кристаллизации частицы аустенита снижалась довольно сильно: почти на 200 К при концентрации 10 ат. % (рис. 4, б). Атомы углерода, диффундируя в решетке металла, часто образовывали скопления, состоящие из нескольких атомов углерода (рис. 5). Такие скопления искажали образующуюся кристаллическую решетку металла вокруг себя, препятствуя кристаллизации. Зародыши кристаллизации возникали преимущественно в объеме частицы, далее следовал интенсивный рост кристаллов и образование поликристаллической структуры.
Рис. 5. Атомная структура частиц аустенита диаметром 8,0 нм, |
На рис. 5 изображена атомная структура кристаллизовавшихся при разной скорости охлаждения частиц диаметром 8,0 нм, содержащих 3 ат. % углерода. При сравнении со структурами, изображенными на рис. 2 для частиц без примеси углерода, следует отметить, что количество структурных несовершенств, границ зерен и других дефектов при наличии углерода заметно больше. Наибольшее отличие наблюдалось для наименьшей из рассмотренных скоростей охлаждения: 5·1011 К/с. Без примеси углерода частица кристаллизовалась с гораздо меньшей плотностью дефектов (рис. 2, в), чем при наличии углерода (рис. 5, в). В последнем случае структура почти не отличалась от структуры, полученной при охлаждении со скоростью 1012 К/с (рис. 5, б). Примесные атомы углерода, особенно скопления из них, закреплялись преимущественно на границах зерен и тройных стыках.
Выводы
Методом молекулярной динамики проведено исследование формирования структуры при кристаллизации наночастиц аустенита в условиях наличия примеси углерода. Рассматривалось влияние скорости охлаждения расплава, размера частиц, концентрации атомов углерода в частице на особенности образующейся структуры при кристаллизации и температуру начала кристаллизации. Показано, что формированием нанокристаллической структуры наночастиц можно управлять путем варьирования скорости охлаждения и введения примеси углерода: при скорости охлаждения выше 1013 К/с в используемой модели кристаллизация не успевала произойти, при скорости ниже 5·1012 К/с частица аустенита кристаллизовалась с образованием нанокристаллической структуры. При этом при уменьшении скорости охлаждения наблюдалось снижение плотности дефектов в конечной структуре. При скорости 5·1011 К/с и менее кристаллизация частиц без углерода проходила с образованием низкоэнергетических границ зерен (с высокой плотностью сопряженных узлов: специальных границ, двойников).
Температура кристаллизации при охлаждении со скоростью ниже 1012 К/с обратно пропорциональна диаметру частицы: по мере уменьшения размера частицы увеличивается доля свободной поверхности, что приводит к уменьшению вероятности образования кристаллических зародышей. Кроме того, температура кристаллизации увеличивается при уменьшении скорости охлаждения.
Введение примеси углерода приводило к снижению температуры кристаллизации наночастиц: при наличии 10 ат. % углерода она уменьшалась примерно на 200 К для частиц разного размера. Атомы углерода часто образовывали скопления, состоящие из нескольких атомов. Такие скопления искажали образующуюся кристаллическую решетку металла вокруг себя, препятствуя кристаллизации. В условиях наличия примеси углерода в конечной структуре кристаллизовавшихся частиц наблюдалась более высокая плотность границ зерен и других дефектов. Атомы углерода, особенно их скопления, закреплялись преимущественно на границах зерен и тройных стыках.
Список литературы
1. Humbert C., Noblet T., Dalstein L., Busson B., Barbillon G. Sum-frequency generation spectroscopy of plasmonic nanomaterials: A review. Materials. 2019;12(5):836. https://doi.org/10.3390/ma12050836
2. Mantri Y., Jokerst J.V. Engineering plasmonic nanoparticles for enhanced photoacoustic imaging. ACS Nano. 2020;14(8): 9408‒9422. https://doi.org/10.1021/acsnano.0c05215
3. Jain T.K., Morales M.A., Sahoo S.K., Leslie-Pelecky D.L., Labhasetwar V. Iron oxide nanoparticles for sustained delivery of anticancer agents. Molecular Pharmaceutics. 2005; 2(3):194–205. https://doi.org/10.1021/mp0500014
4. Shim S.Y., Lim D.K., Nam J.M. Ultrasensitive optical biodiagnostic methods using metallic nanoparticles. Nanomedicine. 2008;3(2):215–232. https://doi.org/10.2217/17435889.3.2.215
5. Kodama K., Nagai T., Kuwaki A., Jinnouchi R., Morimoto Y. Challenges in applying highly active Pt-based nanostructured catalysts for oxygen reduction reactions to fuel cell vehicles. Nature Nanotechnology. 2021;16:140–147. https://doi.org/10.1038/s41565-020-00824-w
6. Mitchell S., Qin R., Zheng N., Perez-Ramirez J. Nanoscale engineering of catalytic materials for sustainable technologies. Nature Nanotechnology. 2021;16:129–139. https://doi.org/10.1038/s41565-020-00799-8
7. Wagener P., Jakobi J., Rehbock C., Chakravadhanula V.S.K., Thede C., Wiedwald U., Bartsch M., Kienleand L., Barcikowski S. Solvent-surface interactions control the phase structure in laser-generated iron-gold core-shell nanoparticles. Scientific Reports. 2016;6:23352. https://doi.org/10.1038/srep23352
8. Ziefub A.R., Reichenberger S., Rehbock C., Chakraborty I., Gharib M., Parak W.J., Barcikowski S. Laser fragmentation of colloidal gold nanoparticles with high-intensity nanosecond pulses is driven by a single-step fragmentation mechanism with a defined educt particle-size threshold. The Journal of Physical Chemistry C. 2018;122(38):22125–22136. https://doi.org/10.1021/acs.jpcc.8b04374
9. Amikura K., Kimura T., Hamada M., Yokoyama N., Miyazaki J., Yamada Y. Copper oxide particles produced by laser ablation in water. Applied Surface Science. 2008;254(21): 6976–6982. https://doi.org/10.1016/j.apsusc.2008.05.091
10. Barcikowski S., Compagnini G. Advanced nanoparticle generation and excitation by lasers in liquids. Physical Chemistry Chemical Physics. 2013;15(9):3022–3026. https://doi.org/10.1039/C2CP90132C
11. Liang S.-X., Zhang L.-C., Reichenberger S., Barcikowski S. Design and perspective of amorphous metal nanoparticles from laser synthesis and processing. Physical Chemistry Chemical Physics. 2021;23(19):11121‒11154. https://doi.org/10.1039/D1CP00701G
12. Sun J., Sinha S.K., Khammari A., Picher M., Terrones M., Banhart F. The amorphization of metal nanoparticles in graphitic shells under laser pulses. Carbon. 2020;161:495‒501. https://doi.org/10.1016/j.carbon.2020.01.067
13. He D.S., Huang Y., Myers B.D., Isheim D., Fan X., Xia G.-J., Deng Y., Xie L., Han S., Qiu Y., Wang Y.-G., Luan J., Jiao Z., Huang L., Dravid V.P., He J. Single-element amorphous palladium nanoparticles formed via phase separation. Nano Research. 2022;15:5575–5580. https://doi.org/10.1007/s12274-022-4173-1
14. Qian Y., Silva A., Yu E., Anderson C.L., Liu Y., Theis W., Ercius P., Xu T. Crystallization of nanoparticles induced by precipitation of trace polymeric additives. Nature Communications. 2021;12(1):2767. https://doi.org/10.1038/s41467-021-22950-2
15. Pei Y., Zhou G., Luan N., Zong B., Qiao M., Tao F. Synthesis and catalysis of chemically reduced metal-metalloid amorphous alloys. Chemical Society Reviews. 2012;41(24): 8140–8162. https://doi.org/10.1039/c2cs35182j
16. Jia Z., Wang Q., Sun L., Wang Q., Zhang L.C., Wu G., Luan J.H., Jiao Z.B., Wang A., Liang S.X., Gu M., Lu J. Metallic glass catalysts: attractive in situ self-reconstructed hierarchical gradient structure of metallic glass for high efficiency and remarkable stability in catalytic performance. Advanced Functional Materials. 2019;29(19): 1970131. https://doi.org/10.1002/adfm.201970131
17. Chen Q., Yan Z., Guo L., Zhang H., Zhang L.-C., Wang W. Role of maze like structure and Y2O3 on Al-based amorphous ribbon surface in MO solution degradation. Journal of Molecular Liquids. 2020;318:114318. https://doi.org/10.1016/j.molliq.2020.114318
18. Kumar K.S., Van Swygenhoven H., Suresh S. Mechanical behavior of nanocrystalline metals and alloys. Acta Materialia. 2003;51(19):5743–5774. https://doi.org/10.1016/j.actamat.2003.08.032
19. Meyers M.A., Mishra A., Benson D.J. Mechanical properties of nanocrystalline materials. Progress in Materials Science. 2006;51(4):427–556. https://doi.org/10.1016/j.pmatsci.2005.08.003
20. Nguyen T.D., Nguyen C.C., Tran V.H. Molecular dynamics study of microscopic structures, phase transitions and dynamic crystallization in Ni nanoparticles. RSC Advances. 2017;7(41):25406‒25413. https://doi.org/10.1039/C6RA27841H
21. Trang G.T.T., Kien P.H., Hung P.K., Ha N.T.T. Molecular dynamics simulation of microstructure and atom-level mechanism of crystallization pathway in iron nanoparticle. Journal of Physics: Conference Series. 2020;1506:012020. https://doi.org/10.1088/1742-6596/1506/1/012020
22. Poletaev G.M., Gafner Y.Y., Gafner S.L. Molecular dynamics study of melting, crystallization and devitrification of nickel nanoparticles. Letters on Materials. 2023;13(4):298‒303. https://doi.org/10.22226/2410-3535-2023-4-298-303
23. Poletaev G.M., Bebikhov Y.V., Semenov A.S. Molecular dynamics study of the formation of the nanocrystalline structure in nickel nanoparticles during rapid cooling from the melt. Materials Chemistry and Physics. 2023;309:128358. https://doi.org/10.1016/j.matchemphys.2023.128358
24. Lau T.T., Forst C.J., Lin X., Gale J.D., Yip S., Van Vliet K.J. Many-body potential for point defect clusters in Fe–C alloys. Physical Review Letters. 2007;98(21):215501. https://doi.org/10.1103/PhysRevLett.98.215501
25. Oila A., Bull S.J. Atomistic simulation of Fe-C austenite. Computational Materials Science. 2009;45(2):235‒239. https://doi.org/10.1016/j.commatsci.2008.09.013
26. Lv B., Chen C., Zhang F., Poletaev G.M., Rakitin R.Y. Potentials for describing interatomic interactions in γFe–Mn–C–N system. Metals. 2022;12(6):982. https://doi.org/10.3390/met12060982
27. Poletaev G., Gafner Y., Gafner S., Bebikhov Y., Semenov A. Molecular dynamics study of the devitrification of amorphous copper nanoparticles in vacuum and in a silver shell. Metals. 2023;13(10):1664. https://doi.org/10.3390/met13101664
28. Gafner Y., Gafner S., Redel L., Poletaev G. Estimation of the structure of binary Ag-Cu nanoparticles during their crystallization by computer simulation. Journal of Nanoparticle Research. 2023;25:205. https://doi.org/10.1007/s11051-023-05850-y
29. Liang S.–X., Zhang L.–C., Reichenberger S., Barcikowski S. Design and perspective of amorphous metal nanoparticles from laser synthesis and processing. Physical Chemistry Chemical Physics. 2021;23(19):11121‒11154. https://doi.org/10.1039/D1CP00701G
30. Zhong L., Wang J., Sheng H., Zhang Z., Mao S.X. Formation of monatomic metallic glasses through ultrafast liquid quenching. Nature. 2014;512:177–180. https://doi.org/10.1038/nature13617
31. Chan W.–L., Averback R.S., Cahill D.G., Ashkenazy Y. Solidification velocities in deeply undercooled silver. Physical Review Letters. 2009;102(9):095701. https://doi.org/10.1103/PhysRevLett.102.095701
32. Zhang H.Y., Liu F., Yang Y., Sun D.Y. The molecular dynamics study of vacancy formation during solidification of pure metals. Scientific Reports. 2017;7:10241. https://doi.org/10.1038/s41598-017-10662-x
33. Qi Y., Cagin Т., Johnson W.L., Goddard III W.A. Melting and crystallization in Ni nanoclusters: the mesoscale regime. The Journal of Chemical Physics. 2001;115(1):385‒394. https://doi.org/10.1063/1.1373664
34. Tsuzuki H., Branicio P.S., Rino J.P. Structural characterization of deformed crystals by analysis of common atomic neighborhood. Computer Physics Communications. 2007; 177(6):518–523. https://doi.org/10.1016/j.cpc.2007.05.018
35. Xiong S., Qi W., Cheng Y., Huang B, Wang M., Li Y. Universal relation for size dependent thermodynamic properties of metallic nanoparticles. Physical Chemistry Chemical Physics. 2011;13(22):10652‒10660. https://doi.org/10.1039/C0CP90161J
36. Nanda K.K. Liquid-drop model for the surface energy of nanoparticles. Physics Letters A. 2012;376(19):1647‒1649. https://doi.org/10.1016/j.physleta.2012.03.055
37. Safaei A., Attarian Shandiz M., Sanjabi S., Barber Z.H. Modeling the melting temperature of nanoparticles by an analytical approach. The Journal of Physical Chemistry C. 2008;112(1):99‒105. https://doi.org/10.1021/jp0744681
Об авторах
И. В. ЗоряРоссия
Ирина Васильевна Зоря, д.ф.-м.н., профессор, заведующий кафедрой теплогазоводоснабжения, водоотведения и вентиляции
Россия, 654007, Кемеровская обл. – Кузбасс, Новокузнецк, ул. Кирова, 42
Г. М. Полетаев
Россия
Геннадий Михайлович Полетаев, д.ф.-м.н., профессор, заведующий кафедрой высшей математики, Алтайский государственный технический университет им. И.И. Ползунова; профессор, Хакасский государственный университет им. Н.Ф. Катанова
Россия, 655012, Республика Хакасия, Абакан, пр. Ленина, 90
Россия, 656038, Алтайский край, Барнаул, пр. Ленина, 46
Ю. В. Бебихов
Россия
Юрий Владимирович Бебихов, к.ф.-м.н., доцент
Россия, 678170, Республика Саха (Якутия), Мирный, ул. Тихонова, 5
А. С. Семенов
Россия
Александр Сергеевич Семенов, д.ф.-м.н., директор
Россия, 678170, Республика Саха (Якутия), Мирный, ул. Тихонова, 5
Рецензия
Для цитирования:
Зоря И.В., Полетаев Г.М., Бебихов Ю.В., Семенов А.С. Молекулярно-динамическое исследование влияния примеси углерода на процесс кристаллизации наночастиц аустенита при быстром охлаждении. Известия высших учебных заведений. Черная Металлургия. 2024;67(4):440-448. https://doi.org/10.17073/0368-0797-2024-4-440-448
For citation:
Zorya I.V., Poletaev G.M., Bebikhov Yu.V., Semenov A.S. Molecular dynamics study of the influence of carbon impurity on austenite nanoparticles crystallization during rapid cooling. Izvestiya. Ferrous Metallurgy. 2024;67(4):440-448. https://doi.org/10.17073/0368-0797-2024-4-440-448