Перейти к:
Влияние водорода на восстановление оксида никеля на поверхности сопловой лопатки газотурбинной установки
https://doi.org/10.17073/0368-0797-2023-5-604-609
Аннотация
В настоящее время растет интерес к использованию водорода в составе топливных смесей для турбореактивных двигателей и газотурбинных установок. Воздействие водорода на жаропрочные никелевые сплавы лопаток газотурбинных установок мало изучено. Данная работа посвящена исследованию влияния водорода на восстановление оксида никеля на поверхности сопловой лопатки газотурбинных установок. Рассмотрено взаимодействие водорода при различных условиях с оксидами металлов, способы восстановления оксидов металлов на поверхности лопаток газотурбинного двигателя. Термодинамика реакций взаимодействия оксидов алюминия, титана, никеля и вольфрама с фтороводородом и реакций фторидов с водородом изучена в диапазоне температур 273 – 1373 К. Установлено, что взаимодействие оксида алюминия с фтороводородом протекает в диапазоне температур от 273 до 1073 К, оксида титана с фтороводородом – от 273 до 373 К, оксида никеля с фтороводородом – от 273 до 873 К. При этом из образовавшихся фторидов с водородом реагирует только фторид никеля при температурах выше 673 К. Водород во всем интервале температур взаимодействует с оксидом никеля, а с оксидом вольфрама – при температурах выше 1173 К. Изучены особенности воздействия водорода на жаропрочные никелевые сплавы лопаток газотурбинных установок, подвергнутых предварительному фторированию и не обработанных соединениями фтора. Установлено, что восстановление оксида никеля водородом лучше протекает после процесса предварительного фторирования. При этом на поверхности образца лопатки образуются частицы размером 2 – 5 мкм, содержащие 90,16 % Ni. Без фторирования процесс восстановления оксида никеля водородом при температуре 1223 К и длительности 1 ч не происходит.
Ключевые слова
Для цитирования:
Фомина Д.Д., Пойлов В.З., Галлямов А.Н. Влияние водорода на восстановление оксида никеля на поверхности сопловой лопатки газотурбинной установки. Известия высших учебных заведений. Черная Металлургия. 2023;66(5):604-609. https://doi.org/10.17073/0368-0797-2023-5-604-609
For citation:
Fomina D.D., Poilov V.Z., Gallyamov A.N. Effect of hydrogen on nickel oxide reduction on the surface of nozzle blade of a gas turbine unit. Izvestiya. Ferrous Metallurgy. 2023;66(5):604-609. https://doi.org/10.17073/0368-0797-2023-5-604-609
Введение
Водород широко используется в химической, энергетической и металлургической отраслях промышленности в качестве топлива, снижающего выбросы углекислого газа в атмосферу, накопителя энергии, химического реагента для синтеза органических продуктов, восстановителя и др. По своим химическим свойствам водород малоактивен, но его активность возрастает, например, при нагревании. При этом молекулярный водород вступает в химическое взаимодействие со многими металлами, неметаллами и сложными веществами. Повышение химической активности водорода при воздействии дополнительных факторов объясняется частичным образованием атомарного водорода, который значительно более активен, чем молекулярный. Водород является отличным восстановителем оксидов металлов до металлов. Восстановительные функции может выполнять и атомарный, и молекулярный водород [1 – 3].
Атомарный водород взаимодействует с твердыми телами на их поверхности при поглощении тепла. Необходимо учитывать способность разных веществ взаимодействовать с атомами водорода. Наиболее сильно катализируют рекомбинацию атомов водорода металлы, активность которых убывает в ряду Pt > Pd > W > Fe > Cr > Ag > Cu > Pb.
При этом рекомбинация атомов водорода (заключается в захвате ионом свободного электрона) наблюдается также на поверхности оксидов MgO, CaO, BaO, Al2O3 , Cr2O3 [4].
Важным фактором является возможность воздействия молекулярного водорода на поверхность металла с оксидной пленкой для удаления этой пленки путем восстановления оксидов до металлов. В данной работе рассмотрено с теоретической и практической точек зрения воздействие водорода на поверхность компонентов сплавов лопаток газотурбинных установок (ГТУ).
Эффективность восстановительной способности водорода описывается в работе [5]. Авторы рассматривают восстановление различных оксидов металлов. Для восстановления используется атомарный водород, образующийся на нагретом вольфрамовом катализаторе. Обнаружено, что оксиды Cu, Ru, Nb, Mo, Rh, Pd, Ir и Pt могут быть восстановлены атомарным водородом при температуре подложки 313 К.
В работах [6; 7] исследованы процессы извлечения никеля из серпентиновой и лимонитовой руд путем выщелачивания при повышенной температуре и значении рН = 13 с последующим восстановлением солей никеля водородом. Представляет интерес использование водородной плазмы [8], создаваемой индуктивным радиочастотным тлеющим разрядом с помощью ВЧ-генератора мощностью 27,12 МГц и 700 Вт плотностью 1 – 3\(^{(10 – 15)}\) м\(^–\)3 при давлении водорода от 0,05 до 50 Па для восстановления оксида меди. Авторы работы [9] аналогично использовали процесс восстановления в плазме Н2 для синтеза фосфидов. Отмечено, что в водородной плазме достигнута высокая эффективность, связанная с повышенной реакционной способностью водорода к восстановлению.
Изучена возможность восстановления оксида железа (III) в атмосфере водорода при его избытке по отношению к оксиду железа. При недостатке водорода процесс восстановления протекает не полностью [10]. Также водород применяется для восстановления катодных материалов в литий-ионных аккумуляторах [11].
При обзоре способов очистки сопловых лопаток, представленных в работах [12; 13], восстановительные свойства водорода используются на одном из этапов очистки поверхности лопаток газотурбинного двигателя (ГТД) от оксидов металлов элементарным фтором [14; 15]. Способ заключается в очищении поврежденных металлических деталей из жаропрочного никелевого сплава, содержащих микротрещины и применяется для ремонта деталей путем пайки. В качестве промежуточного реагента для очистки от оксидов металлов жаропрочных никелевых сплавов используют элементарный фтор, который образует с компонентами сплавов фториды металлов. Источником элементарного фтора являются продукты термического разложения фторуглеродной смолы. Последующая стадия восстановления фторидов металлов производится водородом при повышенных температурах.
Очищенная деталь имеет поверхностный слой, не содержащий оксидов. Отмечено, что поверхность содержит малое количество титана и алюминия, поэтому деталь может хорошо поддаваться пайке.
В патентах [16; 17] описан аналогичный процесс воздействия на деталь атмосферы, содержащей углерод, кислород (в виде угарного газа), водород и фтор (С – О – Н – F). На первой стадии представлен процесс разложения политетрафторэтилена (ПТФЭ) с образованием мономера тетрафторэтилена, который реагирует с водородом и образует фтороводород.
Отличие патентов [16; 17] от [14; 15] заключается в температурном диапазоне воздействия газовой среды 973 – 1073 К при продолжительности процесса 4 ч. При этом образуются фториды металлов. На третьем этапе происходит воздействие водорода на поверхность детали при температурах 1223 – 1373 К.
В литературе отсутствует оценка эффективности процесса восстановления водородом оксидов металлов жаропрочных никелевых сплавов, подвергнутых предварительному фторированию и не обработанных соединениями фтора. В связи с этим, целью настоящего исследования является выявление особенностей процесса восстановления водородом оксидов металлов жаропрочных никелевых сплавов, подвергнутых предварительному фторированию и не обработанных соединениями фтора.
Результаты термодинамического анализа
Термодинамический анализ реакций фторирования
Проведен термодинамический анализ взаимодействия оксидов алюминия, титана, никеля и вольфрама с фтороводородом и реакций взаимодействия фторидов с водородом. Ниже рассмотрены термодинамические характеристики восстановительной способности водорода при взаимодействии с оксидной пленкой на поверхности жаропрочного никелевого сплава ГТУ. Представлены основные реакции, которые могут протекать при проведении процессов. Значения энтальпии и энтропии взяты из справочника [18].
| Al2O3 + 6HF(г) = 2AlF3 + 3H2O; | (1) |
| TiO2 + 4HF(г) = TiF4 + 2H2O; | (2) |
| NiO + 2HF(г) = NiF2 + H2O; | (3) |
| WO3 + 6HF(г) = WF6(г) + 3H2O. | (4) |
Анализ значений энергии Гиббса реакций (1) – (4) показывает, что взаимодействие оксида алюминия с фтороводородом протекает в диапазоне температур от 273 до 1073 К, оксида титана c фтороводородом – от 273 до 373 К и оксида никеля с фтороводородом – от 273 до 873 К. Это доказывают отрицательные значения энергии Гиббса. Реакция взаимодействия оксида вольфрама и фтороводорода не протекает.
Фторид алюминия при температуре выше 873 К возгоняется с поверхности лопатки ГТД. Аналогичная ситуация с возгонкой происходит и при нагревании фторида титана до температуры выше 353 К [19].
Термодинамический анализ реакций фторидов металлов с водородом
Взаимодействие фторидов металлов с водородом может протекать по реакциям
| 2AlF3 + 3H2 = 2Al + 6HF; | (5) |
| TiF4 + 2H2 = Ti + 4HF; | (6) |
| NiF2 + H2 = Ni + 2HF. | (7) |
Из анализа величин энергии Гиббса следует, что реакции (5) и (6) не протекают, так как энергия Гиббса положительная, а реакция восстановления фторида никеля (7) протекает при температуре 673 К и выше.
Термодинамический анализ реакций оксидов металлов с водородом
Взаимодействие оксидов металлов с водородом может протекать по реакциям
| Al2O3 + 3H2(г) = 2Al + 3H2O(г) ; | (8) |
| TiO2 + 2H2(г) = Ti + 2H2O(г) ; | (9) |
| NiO + H2(г) = Ni + H2O(г) ; | (10) |
| WO3 + 3H2(г) = W + 3H2O(г) . | (11) |
Из анализа значений энергии Гиббса реакций (8) – (11) следует, что водород восстанавливает оксид никеля во всем диапазоне рассмотренных температур, а оксид вольфрама реагирует с водородом при температурах выше 1173 К. Данный вывод совпадает с литературными данными1, где отмечено, что процесс восстановления вольфрамового ангидрида протекает в потоке водорода, содержащего влаги не более 2 г/м3, а кислорода – не более 0,4 % (об.).
Экспериментальная часть
В качестве объекта исследования использовали образец сопловой лопатки газотурбинного двигателя, предоставленной АО ОДК «Пермские Моторы».
Для получения фтороводорода и проведения процесса фторирования поверхности образца применяли бифторид калия, который подвергали термическому разложению при температуре выше 1023 К в однозонной трубчатой печи фирмы «Protherm furnaces». Процесс фторирования проводили при температуре 1023 К и продолжительности 2 ч в бескислородной среде. Для этого реактор продували очищенным от следов кислорода аргоном (с помощью медной стружки и титановой губки при температурах до 1073 К). После фторирования осуществляли процесс восстановления поверхности образца водородом, подаваемым с генератора водорода. Процесс проходил при температуре 1223 К и длительности 1 ч. По окончании процесса образец охлаждали в печи без доступа воздуха до комнатной температуры. Далее проводился анализ поверхности образца с помощью электронного сканирующего микроскопа «S-3400N» японской фирмы «HITACHI» с приставкой фирмы «Брукер» (Германия) для рентгеноспектрального и рентгенофлуоресцентного анализов.
Результаты экспериментов, их анализ
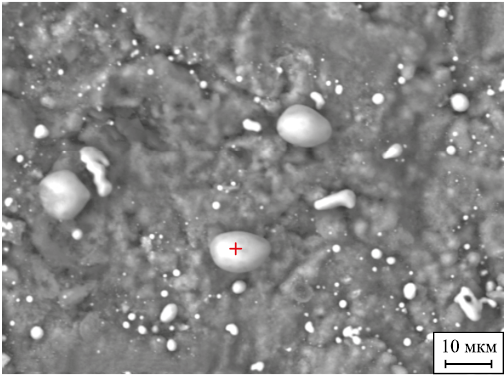
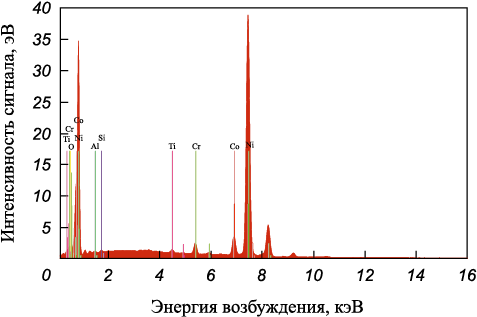
Поверхность образца лопатки после процесса фторирования и восстановления водородом показана на рис. 1, где видны небольшие вкрапления белого цвета, относящиеся к частичкам никеля. При большем увеличении (рис. 2) видно, что частицы никеля имеют шарообразную форму. Состав частиц показан на рис. 3.
Рис. 1. Микрофотография поверхности образца лопатки
Рис. 2. Микрофотография частиц никеля на поверхности образца лопатки
Рис. 3. Спектр частицы никеля на поверхности образца лопатки |
Из рис. 3 следует, что образовавшиеся шарообразные частицы размером 2 – 5 мкм содержат 90,16 % Ni. Таким образом, водород восстанавливает фторид никеля до металлического никеля.
Для сравнения влияния водорода на образец детали проведен эксперимент, в котором изучено взаимодействие нефторированного образца с водородом при температуре 1223 К и продолжительности 1 ч. Результаты взаимодействия образца с водородом представлены на рис. 4. Видно, что на поверхности образца лопатки, в отличие от рис. 1, отсутствуют частицы никеля, т. е. восстановление оксида никеля водородом не наблюдается. В работе [20] отмечено, что конструкционные и функциональные материалы на основе хрома и никеля имеют достаточно высокую стойкость к водороду как при обычных, так и при повышенных температурах. Поскольку процесс восстановления никеля водородом термодинамически возможен, то следует искать причину в кинетике торможения процесса восстановления никеля. Такая причина, по-видимому, связана с тем, что на поверхности образца присутствует плотная пленка оксидов алюминия, титана и вольфрама, которая препятствует процессу восстановления водородом оксида никеля. При воздействии фтористого водорода плотная пленка разрушается путем образования возгоняемых фторидов алюминия и титана, что обеспечивает доступ водорода к зоне реакции восстановления оксида никеля.
Рис. 4. Микрофотография поверхности образца лопатки |
Выводы
Проведен термодинамический анализ взаимодействия оксидов алюминия, титана, никеля и вольфрама с фтороводородом и реакций фторидов с водородом в диапазоне температур 273 – 1373 К. Установлено, что взаимодействие оксида алюминия с фтороводородом протекает в диапазоне температур от 273 до 1073 К, оксида титана с фтороводородом – от 273 до 373 К, оксида никеля с фтороводородом – от 273 до 873 К. При этом из образовавшихся фторидов с водородом реагирует только фторид никеля при температурах выше 673 К. Водород во всем интервале температур взаимодействует с оксидом никеля, а с оксидом вольфрама – при температурах выше 1173 К.
Экспериментальным путем установлено, что восстановление оксида никеля протекает при предварительном фторировании и последующем восстановлении водородом при температуре 1223 К и длительности процесса 1 ч. При этом на поверхности образца лопатки образуются частицы размером 2 – 5 мкм, содержащие 90,16 % Ni. Без фторирования процесс восстановления оксида никеля не наблюдается. Высказано предположение, что причина связана с тем, что на поверхности образца присутствует плотная пленка оксидов алюминия, титана и вольфрама, которая препятствует процессу восстановления водородом оксида никеля. При воздействии фтористого водорода плотная пленка разрушается путем образования возгоняемых фторидов алюминия и титана, что обеспечивает доступ водорода к зоне реакции восстановления оксида никеля.
Список литературы
1. Радченко Р.В. Водород в энергетике. Екатеринбург: Издательство Уральского университета; 2014:229.
2. Оконский И.С., Осокин А.А., Федюков Ю.С. Процессы и аппараты кислородного и криогенного производства. Москва: Машиностроение; 1985:256.
3. Угай Я.А. Общая и неорганическая химия. Москва: Высшая школа; 1997:527.
4. Иоффе В.Б. Основы производства водорода. Ленинград: Государственное научно-техническое издательство нефтяной и горно-топливной литературы; 1960:430.
5. Izumi A., Ueno T., Miyazaki Y., Oizumi H., Nishiyama I. Reduction of oxide layer on various metal surfaces by atomic hydrogen treatment. Thin Solid Films. 2008;516(2-4):853–855. https://doi.org/10.1016/j.tsf.2007.06.097
6. Bryson J.P., Distin P.A. The recovery of nickel from laterrites by chelate formation and reduction with hydrogen. Hydrometallurgy. 1978;3(4):343–354. https://doi.org/10.1016/0304-386X(78)90038-5
7. Crundwell F.K., Moats M.S., Ramachandran V., Robinson T.G., Davenport W.G. Chapter 27 – Hydrogen reduction of nickel from ammoniacal sulfate solution. Extractive Metallurgy of Nickel, Cobalt and Platinum Group Metals. 2011:347–354. https://doi.org/10.1016/B978-0-08-096809-4.10027-9
8. Brecelj F., Mozetic M. Reduction of metal oxide thin layers by hydrogen plasma. Vacuum. 1990;40(1-2):177–181. https://doi.org/10.1016/0042-207X(90)90149-S
9. Guan J., Wang Y., Qin M., Yang Y., Li X., Wang A. Synthesis of transition-metal phosphides from oxidic precursors by reduction in hydrogen plasma. Journal of Solid State Chemistry. 2009;182(6):1550–1555. https://doi.org/10.1016/j.jssc.2009.03.026
10. Jabbour K., El Hassan N. Optimized conditions for reduction of iron (III) oxide into metallic form under hydrogen atmosphere: A thermodynamic approach. Chemical Engineering Science. 2022;252:117297. https://doi.org/10.1016/j.ces.2021.117297
11. Shanker Bhandari G., Dhawan N. Gaseous reduction of NMC-type cathode materials using hydrogen for metal recovery. Process Safety and Environmental Protection. 2023;172: 523–534. https://doi.org/10.1016/j.psep.2023.02.053
12. Логинова Д.И., Фомина Д.Д., Федотова О.А., Пойлов В.З. Способы очистки сопловых лопаток газотурбинного двигателя от оксидов металлов. Вестник ПНИПУ. Химическая технология и биотехнология. 2023;(1):19–34. https://doi.org/10.15593/2224-9400/2023.1.02
13. Fomina D.D., Poilov V.Z. Methods of cleaning the surface of the blades of gas turbine engines from carbon deposits and oxidation products. В кн.: Всероссийская научно-практическая конференция с международным участием «Химия. Экология. Урбанистика» 28–29 апреля 2022 г., Пермь. Пермь: Издательство «ПНИПУ»; 2022:191–194.
14. Pat. US4188237, CPC B23K 1/206. Method for cleaning metal parts with elemental fluorine / Jack W. Cyhasteen. 12.02.1980.
15. Pat. 4324594 US. Method for cleaning metal parts / Cyhasteen J.W. 13.04.1982.
16. Pat. 5071486 US. Process for removing protective coatings and bonding layers from metal parts / Jack W. Cyhasteen. 10.12.1991.
17. Пат. 2419684 RU. Контактный раствор, способ и установка для очистки поверхности металлических сплавов в том числе поверхности трещин и узких зазоров / Пай З.П., Пармон В.Н., Пай В.В., Федотенко М.А., Яковлев И.В., Шангина А.Б.; заявлено 04.06.2009; опубликовано 27.05.2011. Бюллетень № 15.
18. Равделя А.А., Пономарева А.М. Краткий справочник физико-химических величин. Санкт-Петербург: «Иван Федоров»; 2003:240.
19. Мясоедов Б.Ф. Методы концентрирования веществ в аналитической химии. Москва: Наука; 1965:394.
20. Фомина Д.Д., Пойлов В.З. Новые конструкционные и функциональные материалы и покрытия, устойчивые к водородсодержащим средам. Вестник ПНИПУ. Химическая технология и биотехнология. 2022;(2):55–72. https://doi.org/10.15593/2224-9400/2022.2.04
Об авторах
Д. Д. ФоминаРоссия
Дарья Дмитриевна Фомина, ассистент кафедры «Химические технологии»
Россия, 614990, Пермь, Комсомольский пр., 29
В. З. Пойлов
Россия
Владимир Зотович Пойлов, д.т.н., профессор кафедры «Химические технологии», руководитель ЦКП «Центр наукоёмких химических технологий и физико-химических исследований»
Россия, 614990, Пермь, Комсомольский пр., 29
А. Н. Галлямов
Россия
Андрей Николаевич Галлямов, аспирант кафедры «Химические технологии»
Россия, 614990, Пермь, Комсомольский пр., 29
Рецензия
Для цитирования:
Фомина Д.Д., Пойлов В.З., Галлямов А.Н. Влияние водорода на восстановление оксида никеля на поверхности сопловой лопатки газотурбинной установки. Известия высших учебных заведений. Черная Металлургия. 2023;66(5):604-609. https://doi.org/10.17073/0368-0797-2023-5-604-609
For citation:
Fomina D.D., Poilov V.Z., Gallyamov A.N. Effect of hydrogen on nickel oxide reduction on the surface of nozzle blade of a gas turbine unit. Izvestiya. Ferrous Metallurgy. 2023;66(5):604-609. https://doi.org/10.17073/0368-0797-2023-5-604-609
JATS XML