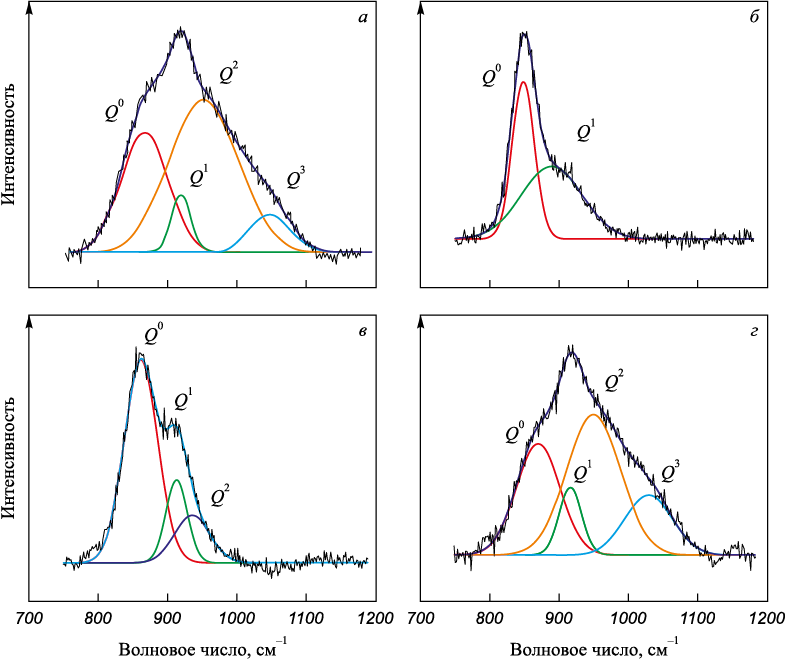Перейти к:
Физические свойства и структура борсодержащих шлаков восстановительного периода АКР-процесса
https://doi.org/10.17073/0368-0797-2023-4-471-478
Аннотация
Влияние основности и содержания оксида бора на вязкость, температуру кристаллизации, фазовый состав и структуру безфтористых шлаков системы СаО – SiO2 – B2O3 – 12 % Cr2O3 – 3 % Аl2O3 – 8 % МgO в диапазоне содержания оксида бора от 3 до 6 % и основности 1,0 – 2,5 были изучены посредством вибрационной вискозиметрии, термодинамического моделирования фазового состава (HSC Chemistry 6.12 (Outokumpu)) и рамановской спектроскопии. Было установлено, что физические свойства изучаемых шлаков главным образом зависят от баланса между степенью полимеризации структуры, природы связи в ней и фазового состава. При низкой основности (примерно 1,0) шлаки являются «длинными» и рост содержания оксида бора с 3 до 6 % делает их более легкоплавкими, снижая температуру кристаллизации шлака с 1340 до 1224 °С, а вязкость – с 1,0 – 0,8 примерно до 0,25 Па·с при температуре 1600 – 1660 °С, несмотря на значительное усложнение структуры, отражающееся в росте показателя мостикового кислорода BO с 1,10 до 1,49. С повышением основности шлаки из «длинных» переходят в «короткие». Растет содержание оксида кальция, который, являясь донором свободных ионов кислорода (O2–), выступает в роли модификатора структуры шлака. При основности B = (CaO/SiO2) = 2,5 шлаки обладают более простой структурой (BO = 0,50 – 0,53) относительно шлаков с основностью 1,0, при этом добавление оксида бора усложняет ее лишь незначительно (рост показателя BO с 0,50 до 0,53). Увеличение концентрации B2O3 понижает температуру кристаллизации с 1674 до 1605 °С и вязкость – с 1,0 до 0,3 Па·с при температуре 1660 °С в результате образования легкоплавких соединений (2CaO·B2O3 ).
Ключевые слова
Для цитирования:
Шартдинов Р.Р., Бабенко А.А., Уполовникова А.Г., Сметанников А.Н. Физические свойства и структура борсодержащих шлаков восстановительного периода АКР-процесса. Известия высших учебных заведений. Черная Металлургия. 2023;66(4):471-478. https://doi.org/10.17073/0368-0797-2023-4-471-478
For citation:
Shartdinov R.R., Babenko A.A., Upolovnikova A.G., Smetannikov A.N. Physical properties and structure of boron-containing slags during reduction period of AOD process. Izvestiya. Ferrous Metallurgy. 2023;66(4):471-478. https://doi.org/10.17073/0368-0797-2023-4-471-478
Введение
На сегодняшний день основным способом выплавки низкоуглеродистой нержавеющей стали является процесс аргоно-кислородного рафинирования (АКР). Рассматриваемая технология была разработана компанией Union Carbide Corp. в США в 1968 г. и уже к началу XXI в. по ней выплавляли около 3/4 всей нержавеющей стали [1].
Процесс АКР состоит из двух периодов (окислительного и восстановительного). Целью окислительного периода является обезуглероживание металла продувкой смесью кислорода и инертного газа до необходимых концентраций содержания углерода при минимизации процесса окисления хрома. Далее проводится восстановительный период, в течение которого металл продувается только инертным газом с целью интенсификации перемешивания и восстановления окислившегося хрома в металл добавками алюминия или кремния. В конце периода восстановления проводится десульфурация металла (образуется шлак с низким содержанием оксида FeO и основностью до 2,0 – 2,5) [1]. Однако возможности глубокого обессеривания металла и эффективного восстановления хрома обусловлены не только химической активностью компонентов оксидной системы, но и обеспечением благоприятных кинетических условий протекания процессов [1 – 3].
Кинетика процессов десульфурации металла и восстановления хрома в значительной степени определяется жидкоподвижностью формируемых шлаков [1; 4]. Скорость диффузии серы и оксида хрома в шлаке обратно пропорциональна его вязкости [2]. В качестве флюса, обеспечивающего низкую вязкость образующегося шлака, часто используют плавиковый шпат [1; 5; 6]. Однако серьезным недостатком использования соединения CaF2 является образование при высоких температурах процесса экологически вредных летучих фторидов [3; 7]. Развитие этого процесса сопровождается снижением рафинирующих свойств формируемых шлаков, повышением экологической нагрузки на окружающую среду и агрессивным воздействием на оборудование. Поэтому возникает необходимость разработки жидкоподвижных рафинировочных шлаков, не содержащих плавиковый шпат. Решением проблемы может стать использование оксида бора, который, взаимодействуя с основными компонентами формируемых шлаков, образует легкоплавкие эвтектики (CaO·B2O3 и 2CaO·B2O3 с температурой плавления 1130 и 1280 °С), обеспечивая высокую их жидкоподвижность.
В настоящей работе при помощи вибрационной вискозиметрии, термодинамического моделирования фазового состава (HSC Chemistry 6.12 (Outokumpu)) и рамановской спектроскопии были изучены вязкость (η), температура кристаллизации (tкр), фазовый состав и структура шлаков системы СаО – SiO2 – B2O3 – 12 % Cr2O3 – 3 % Аl2O3 – 8 % МgO в диапазоне содержания оксида бора от 3 до 6 % и основности 1,0 – 2,5.
Материалы и методика эксперимента
Для исследования свойств шлаков системы СаО – SiO2 – B2O3 – 12 % Cr2O3 – 3 % Аl2O3 – 8 % МgO были сформированы шлаки, состав которых представлен в табл. 1.
Таблица 1. Состав экспериментальных шлаков
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
Шлаки выплавляли в печи сопротивления в молибденовых тиглях в атмосфере аргона из прокаленных в течение 2 – 3 ч при температуре 800 °С (оксид B2O3 – при 100 °С) оксидов марки ч.д.а.
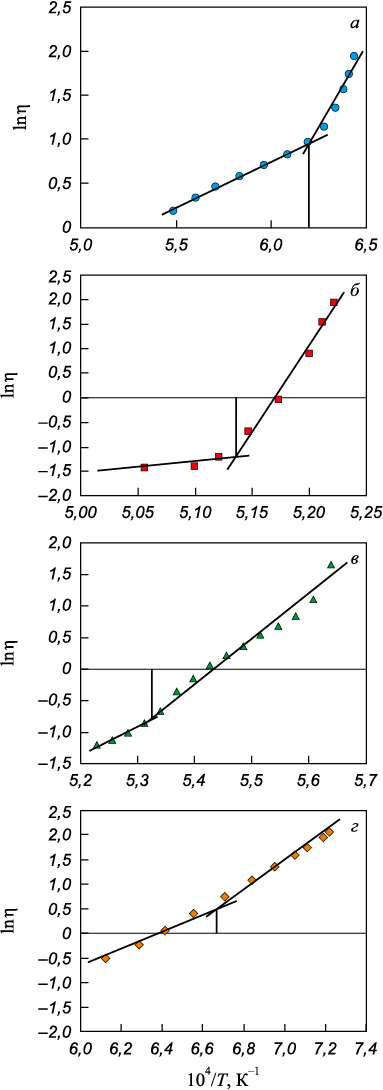
Вязкость полученных шлаков измеряли посредством вибрационного вискозиметра [8] в молибденовых тиглях в атмосфере аргона, замер температуры проводили при помощи вольфрам-рениевой термопары. Полученные данные, характеризующие зависимость вязкости шлаков от температуры, использовали для построения графиков в координатах ln η – 1/T. Перелом политерм вязкости в данных координатах, согласно теории вязкого течения Френкеля, обозначает температуру начала кристаллизации шлаков [9].
Термодинамическое моделирование фазового состава опытных образцов шлака проводили с использованием программного комплекса HSC Chemistry 6.12 (Outokumpu) [10].
Исследование структуры опытных образцов шлака выполняли с использованием рамановского микроскопа-спектрометра U 1000 с лазером с возбуждающей длиной волны 532 нм. Полученные спектры представлены в виде графика в диапазоне волновых чисел 400 – 1500 см\(^ - \)1.
Результаты и обсуждение
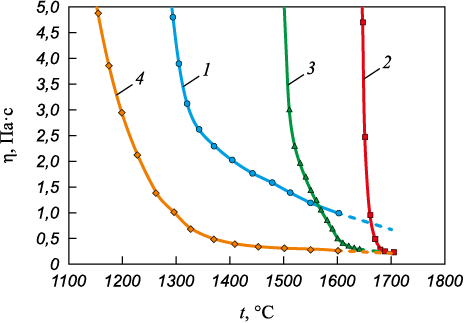
Результаты измерения вязкости шлаков изучаемой оксидной системы представлены на рис. 1, а на рис. 2 они показаны в координатах ln η – 1/T, по перелому зависимости определяли температуру начала кристаллизации (табл. 1).
Рис. 1. Зависимость вязкости шлаков (1 – 4) от температуры
Рис. 2. Зависимость логарифма вязкости (lnη) от обратной |
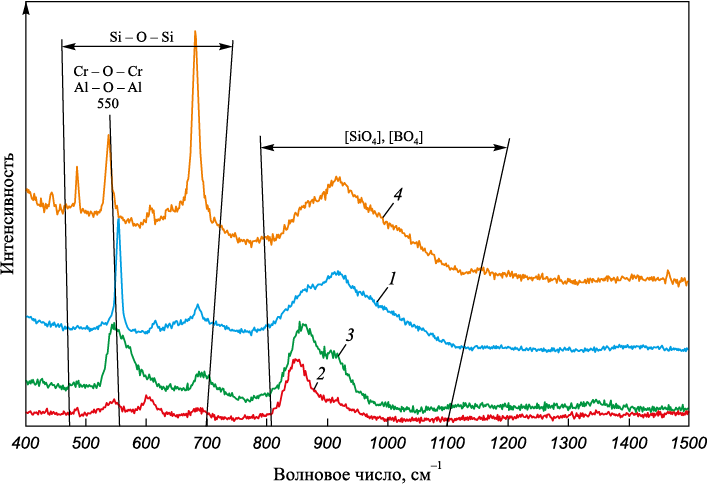
В ходе работы были получены рамановские спектры изучаемых образцов шлаков 1 – 4 (рис. 3).
Рис. 3. Рамановские спектры образцов шлаков 1 (В = 1,0; 3 % В2О3), |
Считается, что степень полимеризации шлака главным образом определяется высокочастотным силикатным диапазоном 800 – 1200 см\(^ - \)1, соответствующим тетраэдрам [SiO4]. Для получения подробной информации о структуре шлака была проведена деконволюция рамановских спектров в рассматриваемом диапазоне по методу Гаусса [11]. Характеристические пики элементов \(Q_{{\rm{Si}}}^n\)([SiO4] с числом мостикового кислорода n) и прочих представлены в табл. 2, а результаты деконволюции – на рис. 4.
Рис. 4. Деконволированные спектры для шлаков 1 – 4 (a – г)
Таблица 2. Соответствие волновых чисел и структур
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Одним из вариантов представления степени полимеризации шлака является среднее количество мостикового кислорода BO. Этот показатель выражается как число атомов мостикового кислорода, умноженного на относительную долю каждой структурной единицы [SiO4], и рассчитывается по формуле (табл. 3):
BO = 0·\(Q_{{\rm{Si}}}^0\) + 1·\(Q_{{\rm{Si}}}^1\) + 2·\(Q_{{\rm{Si}}}^2\) + 3·\(Q_{{\rm{Si}}}^3\) + 4·\(Q_{{\rm{Si}}}^4\).
Таблица 3. Доли силикатных структурных элементов
| |||||||||||||||||||||||||||||||||||||
В табл. 4 представлены результаты термодинамического моделирования фазового состава опытных образцов шлака, которые, исходя из температур плавления формируемых фаз, были условно разделены на три группы: низкотемпературные (1130 – 1280 °С), среднетемпературные (1460 – 1600 °С) и высокотемпературные (1710 – 2852 °С) фазы.
Таблица 4. Фазовый состав экспериментальных шлаков
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Кислые шлаки основностью 1,0 (1 и 4) относятся к категории «длинных» шлаков (рис. 1), которые отличаются высокой степенью полимеризации (табл. 3). На рис. 3 отсутствуют пики, соответствующие соединению [BO3]. Можно предположить, что оксид B2O3 представлен в структуре трехмерными тетраэдрами соединения [BO4], которым соответствуют волновые числа 900 – 920 см\(^ - \)1 (табл. 2).
Согласно результатам деконволюции, шлак 1 с основностью 1,0 и 3 % B2O3 имеет значение показателя BO 1,1 и его структура в основном представлена соединением [SiO4] без мостикового кислорода, с 1 и 2 мостиковым кислородом, доля которых составляет 0,39, 0,17 и 0,41. Сочетание достаточно сложной сетчатой кремний-кислородной структуры (BO = 1,1) с высокой концентрацией высокотемпературных фаз (32,23 %) приводит к тому, что формируемый шлак характеризуется высокой вязкостью 1,0 – 0,8 Па·с при температуре 1600 – 1660 °С и температурой кристаллизации 1340 °С (табл. 1).
Увеличение содержания оксида бора до 6 % приводит к еще большей полимеризации шлака 4 (BO = 1,49). Наблюдается рост доли Q2 до 0,45 и Q3 до 0,17 за счет величин Q\(^ 0 \) и Q1. При этом в шлаке увеличивается количество легкоплавких соединений до 26,3 % при снижении содержания высокотемпературных фаз (30,66 %). Несмотря на наличие еще более сложной сетчатой кремний-кислородной структуры (BO = 1,49), присутствие повышенной концентрации оксида бора в формируемом шлаке в виде тетраэдров [ВО4], которые, внедряясь в сложную кремний-кислородную решетку, ослабляют ее, так как образующиеся связи B – O\(^ 0 \) слабее связей Si – O\(^ 0 \). Такое «ослабление» структуры шлака в совокупности с увеличением доли легкоплавких соединений обеспечивает снижение вязкости шлака 4 примерно до 0,25 Па·с при температуре 1600 – 1660 °С.
Шлаки 2 и 3 высокой основности 2,5 гораздо более «короткие» и характеризуются низкой степенью полимеризации (рис. 1, табл. 3). С увеличением основности шлаков до 2,5 пик в силикатной области спектра 800 – 1200 см\(^ - \)1 смещается в сторону уменьшения волнового числа (рис. 3), поскольку оксид кальция CaO является источником свободных ионов кислорода (O2\(^ - \)) и выступает в роли модификатора структуры шлака. Свободные ионы кислорода (O2\(^ - \)) будут реагировать с мостиковым кислородом (O\(^ 0 \)) в силикатах, снижая сложность связей Si – O в структуре шлака. Таким образом, рост содержания оксида CaO способствует развитию процесса деполимеризации [19 – 23]. Пики в районе волновых чисел 500 – 650 см\(^ - \)1 соответствуют связям Cr – O – Cr, Si – O – Si и Al – O – Al. С увеличением основности пики сглаживаются, что говорит об ослаблении связей.
Содержащий 3 % оксида бора шлак 2 имеет наименьшую сложность структуры, представленной равным количеством величин Q\(^ 0 \) и Q1 (BO = 0,5). Обладая простой кремний-кислородной структурой с небольшим количеством мостикового кислорода, шлак отличается высокой долей тугоплавких фаз (более 65 %) и незначительной долей легкоплавких (2,94 %), в результате чего его температура кристаллизации составляет 1676 °С, а вязкость – 1,0 Па·с при температуре 1660 °С.
Повышение содержания оксида бора до 6 % в шлаке 3 практически не отражается на степени его полимеризации относительно шлака 2 (количество мостикового кислорода не превышает 0,53). В структуре присутствуют Q\(^ 0 \), Q1 и Q2, доля которых составляет 0,63, 0,21 и 0,16. Однако рост содержания до 8,05 % легкоплавких фаз и снижение доли тугоплавких до 53,86 % благоприятно сказывается на температуре кристаллизации (1605 °C) и вязкости шлака, которая снизилась до 0,5 – 0,3 Па·с в диапазоне 1600 – 1660 °С.
Полученные данные о влиянии основности шлаков и содержания в них оксида бора на фазовый состав, структуру, вязкость и температуру кристаллизации показывают, что вязкость формируемых шлаков зависит от баланса между степенью полимеризации структуры, природы связи в ней и фазового состава.
Выводы
В результате проведенного исследования получены новые данные о влиянии основности и содержания оксида бора на вязкость, температуру кристаллизации, фазовый состав и структуру шлаков системы СаО – SiO2 – B2O3 – 12 % Cr2O3 – 3 % Аl2O3 – 8 % МgO в диапазоне содержания оксида бора от 3 до 6 % и основности 1,0 – 2,5.
Показано, что физические свойства изучаемых шлаков главным образом зависят от баланса между степенью полимеризации структуры, природы связи в ней и фазового состава. При низкой основности 1,0 рост содержания оксида бора с 3 до 6 % делает шлак более легкоплавким, снижая температуру кристаллизации шлака с 1340 до 1224 °С и его вязкость – с 1,0 – 0,8 примерно до 0,25 Па·с при температуре 1600 – 1660 °С, несмотря на значительное усложнение структуры, отражающееся в росте показателя BO с 1,10 до 1,49.
При высокой основности (B = 2,5) шлаки обладают более простой структурой (BO = 0,50 – 0,53), при этом добавление оксида бора усложняет ее лишь незначительно (с 0,50 до 0,53). Рост содержания B2O3 понижает температуру кристаллизации с 1674 до 1605 °С и вязкость – с 1,0 до 0,3 Па·с при температуре 1660 °С в результате образования легкоплавких соединений.
Список литературы
1. Токовой О.К. Аргонокислородное рафинирование нержавеющей стали. Челябинск: ИЦ ЮУрГУ; 2015:250.
2. Попель С.И., Сотников А.И., Бороненков В.Н. Теория металлургических процессов. Москва: Металлургия; 1986:463.
3. Дюдкин Д.А., Кисиленко В.В. Производство стали. В 3-х томах. Т. 3. Внепечная металлургия стали. Москва: Теплотехник; 2010:544.
4. Явойский В.И., Явойский А.В. Научные основы современных процессов производства стали. Москва: Металлургия; 1987:184.
5. Магидсон И.А., Морозов А.С., Сидоренко М.Ф. и др. Вязкость хромистых шлаков. Известия вузов. Черная металлургия. 1973;16(11):61–64.
6. Kalicka Z., Kawecka-Cebula E., Pytel K. Application of the Iida model for estimation of slag viscosity for Al2O3–Cr2O3–CaO–CaF2 systems. Archives of Metallurgy and Materials. 2009;54(1):179–187.
7. Поволоцкий Д.Я., Рощин В.Е., Грибанов В.П. и др. Влияние SiO2 на летучесть шлаков системы Al2O3–Al2O3–CaF2. Известия вузов. Черная металлургия. 1982;25(8):39–42.
8. Штенгельмейер С.В., Прусов В.А., Богечов В.А. Усовершенствование методики измерения вязкости вибрационным вискозиметром. Заводская лаборатория. 1985;9:56–57.
9. Воскобойников В.Г. и др. Свойства доменных шлаков. Москва: Металлургия; 1975:180.
10. Roine A. HSC 6.0 Chemistry Reactions and Equilibrium Software with Extensive Thermochemical Database and Flowshut. Pori.: Outokumpu research Oy; 2006:448.
11. Mysen B.O., Virgo D., Scarfe C.M. Relations between the anionic structure and viscosity of silicate melts-a Raman spectroscopic study. American Mineralogist. 1980;65(7): 690–710.
12. McMillan P. Structural studies of silicate glasses and melts-applications and limitations of Raman spectroscopy. American Mineralogist. 1984;69(6):622–644.
13. Matson D.W., Sharma S.K., Philpotts J.A. The structure of high-silica alkali-silicate glasses. A Raman spectroscopic investigation. Journal of Non-Crystalline Solids. 1983;58(2-3):
14. –352. https://doi.org/10.1016/0022-3093(83)90032-7
15. McMillan P.F., Poe B.T., Gillet P.H., Reynard B. A study of SiO2 glass and supercooled liquid to 1950 K via high-temperature Raman spectroscopy. Geochimica et Cosmochimica Acta. 2001;58(17):3653–3662. https://doi.org/10.1016/0016-7037(94)90156-2
16. Kim T.S., Park J.H. Structure-viscosity relationship of low-silica calcium aluminosilicate melts. ISIJ International. 2014;54(9):2031–2038. https://doi.org/10.2355/isijinternational.54.2031
17. Dines T.J., Inglis S. Raman spectroscopic study of supported chromium (VI) oxide catalysts. Physical Chemistry Chemical Physics. 2003;5(6):1320–1328. https://doi.org/10.1039/b211857b
18. Kim Y., Morita K. Relationship between molten oxide structure and thermal conductivity in the CaO–SiO2–B2O3 system. ISIJ International. 2014;54(9):2077–2083. https://doi.org/10.2355/isijinternational.54.2077
19. Cochain B., Neuville D.R., Henderson G.S., McCammon C.A., Pinet O., Richet P. Effects of the iron content and redox state on the structure of sodium borosilicate glasses: A Raman, Mössbauer and boron K‐Edge XANES spectroscopy study. Journal of the American Ceramic Society. 2012;95(3):962–971. https://doi.org/10.1111/j.1551-2916.2011.05020.x
20. Mysen B.O., Virgo D., Seifert F.A. The structure of silicate melts: Implications for chemical and physical properties of natural magma. Reviews of Geophysics. 1982;20(3):
21. –382. https://doi.org/10.1029/RG020i003p00353
22. Mysen B.O. Relationships between silicate melt structure and petrologic processes. Earth-Science Reviews. 1990;27(4): 281–365. https://doi.org/10.1016/0012-8252(90)90055-Z
23. Mills K.C. The influence of structure on the physico-chemical properties of slags. ISIJ International. 1993;33(1):148–155. https://doi.org/10.2355/isijinternational.33.148
24. Park J.H. Structure–property correlations of CaO–SiO2–MnO slag derived from Raman spectroscopy. ISIJ International. 2012;52(9):1627–1636. https://doi.org/10.2355/isijinternational.52.1627
25. Park J.H. Composition-structure-property relationships of CaO–MO–SiO2 (M = Mg2+, Mn2+) systems derived from micro-Raman spectroscopy. Journal of Non-Crystalline Solids. 2012;358(23):3096–3012. https://doi.org/10.1016/j.jnoncrysol.2012.08.014
Об авторах
Р. Р. ШартдиновРоссия
Руслан Рафикович Шартдинов, младший научный сотрудник лаборатории стали и ферросплавов
Россия, 620016, Свердловская обл., Екатеринбург, ул. Амудсена, 101
А. А. Бабенко
Россия
Анатолий Алексеевич Бабенко, д.т.н., профессор, ведущий научный сотрудник
Россия, 620016, Свердловская обл., Екатеринбург, ул. Амудсена, 101
А. Г. Уполовникова
Россия
Алена Геннадьевна Уполовникова, к.т.н., старший научный сотрудник лаборатории стали и ферросплавов
Россия, 620016, Свердловская обл., Екатеринбург, ул. Амудсена, 101
А. Н. Сметанников
Россия
Артем Николаевич Сметанников, младший научный сотрудник лаборатории стали и ферросплавов
Россия, 620016, Свердловская обл., Екатеринбург, ул. Амудсена, 101
Рецензия
Для цитирования:
Шартдинов Р.Р., Бабенко А.А., Уполовникова А.Г., Сметанников А.Н. Физические свойства и структура борсодержащих шлаков восстановительного периода АКР-процесса. Известия высших учебных заведений. Черная Металлургия. 2023;66(4):471-478. https://doi.org/10.17073/0368-0797-2023-4-471-478
For citation:
Shartdinov R.R., Babenko A.A., Upolovnikova A.G., Smetannikov A.N. Physical properties and structure of boron-containing slags during reduction period of AOD process. Izvestiya. Ferrous Metallurgy. 2023;66(4):471-478. https://doi.org/10.17073/0368-0797-2023-4-471-478
JATS XML