Перейти к:
Термодинамическая оценка условий совместного восстановления цинка и железа углеродом из оксидов концентратов и отходов металлургических производств
https://doi.org/10.17073/0368-0797-2023-4-459-470
Аннотация
Рассматриваются теоретические вопросы восстановления цинка и железа углеродом из оксидов концентратов и цинксодержащих металлургических отходов (пыли и шламы металлургических печей). Показана возможность параллельного восстановления цинка и железа углеродом из оксидов с образованием твердых металлических растворов Fe – Zn, содержащих до 46 % цинка (по массе), расплавов и парогазовой фазы CO – CO2 – Zn, равновесный состав которой определяется температурой и содержанием цинка в твердых растворах и расплавах. Определены активности и упругости пара цинка в твердых растворах и расплавах системы Fe – Zn и активности компонентов в шлаковых расплавах системы ZnO – SiO2 . Термодинамическая оценка показывает, что при отсутствии твердого углерода восстановление цинка из оксида оксидом углерода CO возможно при температурах выше 1320 °С, а восстановление железом возможно в интервале температур 1320 – 1500 °С. При восстановлении из шлаковых расплавов при пониженных значениях активностей оксидов цинка и железа и повышенных температурах восстановление цинка осуществляется более эффективно, чем восстановление железа. В присутствии твердого углерода во всех диапазонах температур (выше 620 °С) и концентраций оксидов цинка ZnO и железа FeO при значениях aZnO > 0, aFeO > 0,4 восстановление железа проходит более эффективно ( \(\Delta G_{\rm{FeO}}^{\rm{o}} \) < \(\Delta G_{\rm{ZnO}}^{\rm{o}} \)). При совместном восстановлении железа и цинка первичным продуктом восстановления является твердое железо. Термодинамически возможное внедрение атомов цинка в твердый раствор α-железа практически не реализуется из-за высокой упругости пара цинка уже при небольших его концентрациях в наружных слоях на поверхностях кристаллических зародышей α-железа, что обуславливает возможность достаточно глубокой степени восстановления и возгонки цинка при углеродотермическом восстановлении его из концентратов и отходов металлургических производств.
Ключевые слова
Для цитирования:
Якушевич Н.Ф., Протопопов Е.В., Темлянцев М.В., Строкина И.В. Термодинамическая оценка условий совместного восстановления цинка и железа углеродом из оксидов концентратов и отходов металлургических производств. Известия высших учебных заведений. Черная Металлургия. 2023;66(4):459-470. https://doi.org/10.17073/0368-0797-2023-4-459-470
For citation:
Yakushevich N.F., Protopopov E.V., Temlyantsev M.V., Strokina I.V. Thermodynamic assessment of conditions for co-reduction of zinc and iron by carbon from oxides of concentrates and waste from metallurgical enterprises. Izvestiya. Ferrous Metallurgy. 2023;66(4):459-470. https://doi.org/10.17073/0368-0797-2023-4-459-470
Введение
Восстановление цинка углеродом из концентратов или отходов металлургических производств (пыли, шламы) является основной промежуточной стадией в технологиях получения цинка и цинкита (ZnO). Известны многочисленные технологические варианты, осуществляемые при температурах 1100 – 1290 °С: термическая обработка в барабанных печах (вельц-процесс), в многоподовых шахтных печах (PRIMUS процесс), в кольцевых печах (DRIVIRON процесс) и др. Эти технологии позволяют, как правило, «отогнать» цинк, получающийся в процессе восстановления в парообразном состоянии, с последующим улавливанием парообразного цинка в конденсационных аппаратах или оксида цинка в виде пылеобразного концентрата, содержащего до 65 % (здесь и далее по массе) (вращающиеся печи) или до 96 % (многоподовые печи) оксида цинка, пригодного для получения электролитического металлического цинка, красок, резины и др. [1 – 3].
Оставшийся после отгонки цинка продукт, чаще всего в виде шлаков, содержащих до 30 % железа, или металлизованных окатышей, в которых содержится до 50 % (PRIMUS процесс) или до 96 % (DRIVIRON процесс) восстановленного металлического железа, используется в качестве сырьевых компонентов при выплавке чугуна, стали, ферросплавов [2].
Несмотря на необходимость теоретического обоснования многочисленных технологических вариантов, параметры большинства используемых режимов основаны на результатах кинетических исследований реакций взаимодействия оксидов железа и цинка с углеродом и практического выбора корректных параметров и конструкций используемых агрегатов.
Практически отсутствует комплексный термодинамический анализ совместного восстановления оксидов железа и цинка с учетом образования твердых растворов и расплавов Fe – Zn, химических соединений ZnO·Fe2O3 (феррит цинка), (Mn, Zn)Fe2O4 (франклинит), растворов ZnO·Fe2O3 – 2ZnO·5Fe2O3 ; отсутствует информация по активностям компонентов в твердых растворах Fe – Zn, металлических и шлаковых расплавах, составам парогазовой фазы над растворами и расплавами. Упрощенные схемы многопараметрического механизма физико-химических взаимодействий, протекающих в системе Fe – Zn – C – O, не дают возможности правильного выбора параметров технологического режима конкретного процесса.
В настоящей работе сделана термодинамическая оценка условий совместного восстановления углеродом цинка и железа из оксидов, содержащихся в отходах металлургического производства (пыли и шламы, образующиеся при плавке чугуна и стали в электродуговых сталеплавильных печах и конвертерах).
Термодинамический анализ
Примерный состав цинксодержащих материалов, используемых в углеродотермических восстановительных процессах, приведен в таблице [1; 2; 4; 5].
Состав цинксодержащих материалов
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
В работе [6] показано, что цинкит (ZnO) и гематит (Fe2O3) образуют соединение феррит цинка (ZnO·Fe2O3), или в присутствии оксида марганца MnO – франклинит (Zn, Mn)Fe2O4 , устойчивые в интервале температур 700 – 1100 °С. Эти соединения при избытке Fe2O3 образуют твердые растворы гематит – феррит (или франклинит), вплоть до стехиометрического соотношения 2ZnO + 5Fe2O3 , сохраняющие до 1100 °С шпинелидную структуру в чистом виде. При соотношении Fe2O3:ZnO более 2,5 в спеченых продуктах присутствует магнетит (Fe3O4), при Fe2O3:ZnO менее 1,0 – присутствует цинкит.
В пылях дуговых сталеплавильных печей, содержащих 50 – 60 % Fe2O3 , 0,5 – 4,0 % MnO и примерно 10 – 25 % ZnO [1; 2] (соотношение Fe2O3:(ZnO + MnO) ˃ 3), всегда присутствуют франклинит и магнетит (FeO и ZnO, как правило, отсутствуют).
Совместное восстановление железа и цинка из пылевых отходов осуществляется по сложной многоступенчатой схеме. На первом этапе в восстановительной атмосфере феррит цинка легко разлагается по реакции
| ZnO·Fe2O3 + 1/3CO = ZnO + 2/3Fe3O4 + 1/3CO2 . | (1) |
На втором этапе присутствующие в цинксодержащих материалах высшие оксиды железа и образовавшийся в процессе разложения феррита магнетит восстанавливаются газообразным оксидом углерода CO по реакциям:
| 3Fe2O3 + CO = 2Fe3O4 + CO2 ; | (2) |
| Fe3O4 + CO = 3FeO + CO2 . | (3) |
Уже при 550 °С реакция (3) реализуется при содержании оксида углерода CO в газовой фазе (состоящей из СО и СО2) примерно 50 %; при 640 °С равновесное значение PCO составляет примерно 0,4; при более высоких температурах реакция (3) может протекать при низких концентрациях оксида углерода СO: при 1000 °С PCO ≈ 0,2 ат; при 1200 °С PCO ≈ 0,1 ат [7].
На третьем этапе восстановление железа из вюстита оксидом углерода CO по реакции
| FeO(тв) + CO = Fe(тв) + CO2 | (4) |
осуществляется при более высоких концентрациях оксида углерода CO в газовой фазе (при 700 °С PCO ≥ 0,6 ат, СО:СО2 ≈ 1,5; при 400 °С PCO ≥ 0,68 ат, СО:СО2 ≈ 2; при 1300 °С PCO ≥ 0,76 ат, СО:СО2 ≈ 2,7 [8]).
Аналогично осуществляется восстановление цинка из оксида по реакции
| ZnO(тв) + CO = Zn(ж, г) + CO2 , | (5) |
однако этот процесс осложняется интенсивным испарением цинка, образованием твердых растворов α-Fe – Zn и расплавов Fe – Zn.
В присутствии твердого углерода или при возможности его образования при разложении оксида углерода CO восстановление оксидов на всех этапах может осуществляться при непосредственном контактном взаимодействии оксидов с твердым углеродом (прямое восстановление). Термодинамически такой процесс более выгоден, однако для его эффективного осуществления необходимо тонкое измельчение и хорошее смешение реагентов с целью получения максимальной поверхности взаимодействия реагентов. Состав равновесной газовой фазы в этом случае лимитируется равновесием реакции Будуара
| CO2 + С = 2CO. | (6) |
Для практической реализации технологий углеродотермического восстановления наиболее важно определение параметров фазово-химических взаимодействий, протекающих на третьем – заключительном – этапе процесса.
В качестве исходных данных для термодинамического анализа приняты: один из новейших вариантов диаграммы состояния системы железо – цинк [9], значительно отличающийся от приведенных ранее в справочной литературе (рис. 1 работы [10]); диаграмма фазово-химических равновесий системы Fe – С – О (рис. 4 работы [11]); справочные данные по термодинамическим свойствам оксидов железа, цинка, углерода [12 – 14].
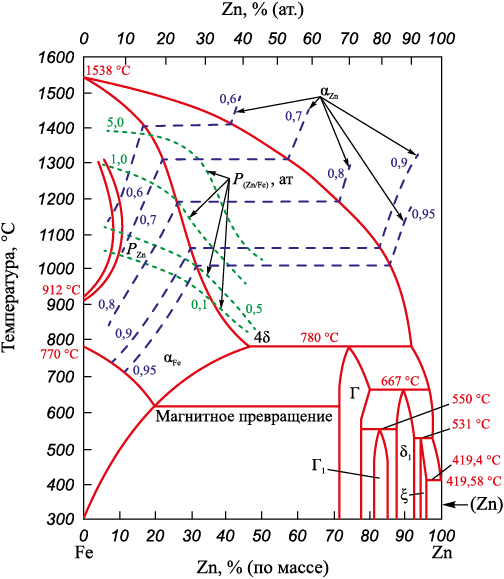
Рис. 1. Диаграмма состояния системы Fe – Zn: |
В соответствии с диаграммой состояния сплавов Fe – Zn [9] цинк плавится при температуре 419,6 °С (эвтектика, содержащая менее 0,1 % Fe – при 419,4 °С), при повышении температуры до 531 °С растворимость железа в цинковом расплаве увеличивается (примерно до 2,5 %), при превышении равновесных значений концентраций железа из расплава выделяется твердый раствор – фаза ζ (Zn ≈ 94 ÷ 97 %), которая до 531 °С находится в равновесии с твердым раствором, а при 531 °С разлагается по перитектической реакции с выделением фазы δ1 (твердый раствор Zn ≈ 88 ÷ 92 %), которая до 550 °С сосуществует с фазой «Г1» (81 – 86 % Zn), разлагающейся при 550 °С с образованием фазы «Г», сосуществующей до 667 °С с фазами δ- и α-железа, а в интервале температур 667 – 780 °С с α-ферритом и жидким расплавом, содержащим, соответственно, железа от 2,5 до 8,5 %. При 780 °С фаза «Г» разлагается по перитектической реакции на жидкий расплав, содержащий примерно 8 % железа, и твердый раствор на основе α-феррита с содержанием цинка 46 %. При более низких (300 °С) и более высоких (до 1535 °С) температурах содержание цинка в ферритном растворе уменьшается практически до нулевых значений. Таким образом, область твердых растворов Fe – Zn простирается в интервале концентраций цинка 0 – 46 % в растворе и температур 0 – 1535 °С. Еще более широкая (по суммарной концентрации цинка) двухфазная область сосуществования твердых растворов на основе железа, содержащих от 0 – 46 % Zn, и жидких расплавов Fe – Zn с содержанием цинка от 0 (при 1535 °С) до 92 % (при 780 °С).
Твердые растворы Fe – Zn на основе α-феррита претерпевают магнитное превращение в интервале температур 769 °С (0 % Zn) – 623 °C (20 % Zn).
Цинк обладает высокой упругостью пара. Зависимость давления пара цинка над чистым цинком описывается уравнением
| \[\lg P_{\rm{Zn}}^{\rm{o}} = - \frac{{6171}}{T} + 5,423,\] |
в соответствии с которым \(P_{\rm{Zn}}^{\rm{o}} \) = 0,1 ат при 720 °С, \(P_{\rm{Zn}}^{\rm{o}} \) = 1 ат при 907 °С, \(P_{\rm{Zn}}^{\rm{o}} \) = 10 ат при 1183 °С, \(P_{\rm{Zn}}^{\rm{o}} \) = 57 ат при 1500 °С. Равновесные значения давления пара цинка над твердыми растворами α-Fe – Zn и расплавами изменяются в соответствии с изменением активности цинка в них и температуры aZnO = f (xZn , T).
Поскольку данные по активностям компонентов в системе Fe – Zn отсутствуют, в качестве прототипа принята система Fe – Cu, в которой также имеется широкая область существования твердых растворов на основе феррита α-Fe – Cu (Cu ≈ 0 ÷ 8 %), граничащая в интервале температур 1094 – 1484 °С с еще более широкой двухфазной областью: твердый раствор (α-Fe) – расплав (Cu = 8(1484 °С) ÷ 97(1094 °) %) [10]. В расплавах Fe – Cu наблюдаются значительные положительные отклонения от закона Рауля. При 1550 °С в расплавах Fe – Cu с содержанием меди 0 – 4 % γCu = 10,1. При повышении концентрации меди в расплаве активность меди снижается: при xCu = 0,1 (10 %) – γCu = 5,4, aCu = 0,56; при xCu = 0,2 (18 %) – γCu = 13,8, aCu = 0,71; при xCu = 0,4 (37 %) – γCu = 2,0, aCu = 0,8; при xCu = 0,8 (70 %) – γCu = 1,2, aCu = 0,89 [15]. Необходимо иметь в виду, что в гомогенных расплавах с положительными отклонениями от закона Рауля при понижении температуры эти положительные отклонения активностей увеличиваются, а при достижении линий концентрационной зависимости ai = f (xi , T) = const для составов, соответствующих при данной температуре xi ликвидуса, значения ai в пределах двухфазной области остаются постоянными вплоть до достижения xi солидуса. При этом положительные отклонения от закона Рауля еще более увеличиваются. Далее активность компонентов в гомогенном твердом растворе уменьшается по мере уменьшения их концентрации в растворе.
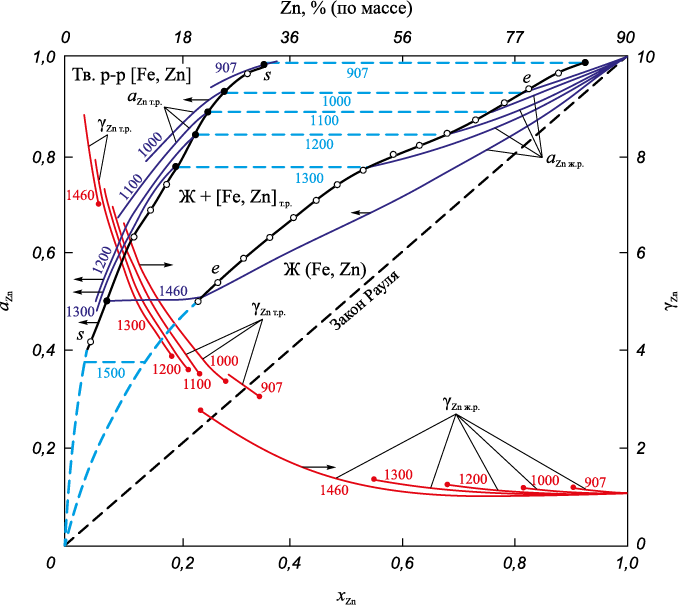
Принятые в соответствии с данными предпосылками значения активностей и коэффициентов активности цинка в твердых растворах и расплавах Fe – Zn представлены на рис. 2.
Рис. 2. Зависимость активности и коэффициента активности цинка от состава и температуры |
В расплавах с высоким (более 50 %) содержанием цинка коэффициенты активности цинка мало отличаются от единицы, а активности цинка имеют небольшие положительные отклонения от закона Рауля. В твердых растворах при содержании в растворе цинка 5 – 25 % и температурах 1000 – 1400 °С активности цинка составляют 0,5 – 0,9, а коэффициенты активности – γZn = 5 ÷ 9, то есть наблюдаются большие положительные отклонения от закона Рауля.
Соответственно, упругость пара цинка даже над твердыми растворами (α-Fe, Zn), содержащими относительно небольшое количество цинка (5 – 10 %), оказывается значительной. Равновесные значения активностей цинка в твердых растворах и расплавах и упругости пара цинка над твердыми растворами нанесены на диаграмму состояния системы Fe – Zn (рис. 1). Из приведенных данных следует, что при содержании цинка в твердом растворе α-железа 5 – 10 % упругость пара цинка при t ≈ 1050 °С достигает 0,5 ат, а при 1300 °С – более 1 ат. При увеличении концентрации цинка в твердом растворе упругость пара цинка повышается, например, при t ≈ 1050 °С достигает 0,1 ат и до 0,5 ат при содержании 5 и 20 % цинка соответственно.
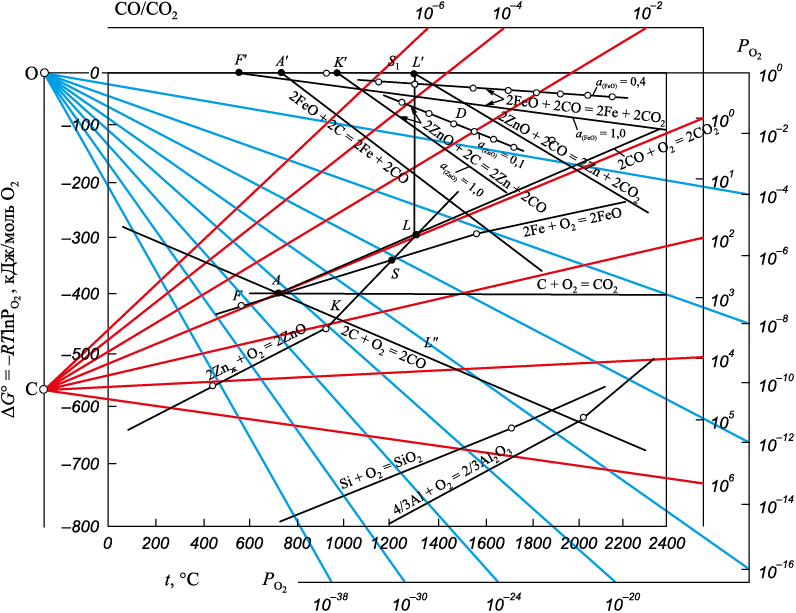
Результаты термодинамического анализа процессов восстановления железа и цинка из оксидов представлены на рис. 3 в виде зависимостей функций ΔG° = f (T), приведенных к 1 молю кислорода в исходной газовой фазе для реакций образования оксидов и соответствующему этому соотношению количеству молей исходного оксида для реакций восстановления.
Рис. 3. Зависимость энергии Гиббса и равновесных составов газовой фазы (CO:CO2 ; PO2) |
Восстановление железа из вюстита оксидом углерода CO по реакции (4)
| 2FeO(тв, ж) + 2CO = 2Fe(тв) + 2CO2 |
в отсутствии твердого углерода начинается при 580 °С (точка F на рис. 3 – пересечение линий ΔG° = f (T) для реакций (6) и (7)):
2СО + O2 = 2СО2 ; 2Fe(тв) + O2 = 2FeО(тв). | (7) |
Для реакции (4) при t = 580 °С \(\Delta G_{\rm{(4)}}^{\rm{o}} \) = 0 (точка F′), PCO:PCO2 = 1, PO2 ≈ 10\(^-\)25 ат; при t = 1200 °С \(\Delta G_{\rm{(4)}}^{\rm{o}} \) = –25 кДж; при t = 1500 °С \(\Delta G_{\rm{(4)}}^{\rm{o}} \) = –55 кДж.
Восстановление цинка из цинкита оксидом углерода CO по реакции (5)
| 2ZnO(тв) + 2CO = 2Zn(г) + 2CO2 |
начинается при более высоких температурах. Для точки L′ на рис. 3 tнач ≈ 1320 °С, \(\Delta G_{\rm{(5)}}^{\rm{o}} \) = 0, PO2 ≈ 10\(^-\)10 ат; при t = 1500 °С \(\Delta G_{\rm{(5)}}^{\rm{o}} \) = –55 кДж. При t = 1500 °С линии ΔG° = f (T) для реакций (4) и (5) пересекаются при \(\Delta G_{\rm{(4)}}^{\rm{o}} \) = \(\Delta G_{\rm{(5)}}^{\rm{o}} \) = –55 кДж (точка D на рис. 3).
При температурах менее 1500 °С \(\Delta G_{\rm{(4)}}^{\rm{o}} \) < \(\Delta G_{\rm{(5)}}^{\rm{o}} \), при t ˃ 1500 °С \(\Delta G_{\rm{(5)}}^{\rm{o}} \) < \(\Delta G_{\rm{(4)}}^{\rm{o}} \). Можно полагать, что в интервале температур 1320 – 1500 °С в условиях восстановительной атмосферы, необходимой для получения металлического железа по реакции (1) – (PCO:PCO2 > 1, PO2 < 10\(^-\)8 ат), восстановленное железо может служить восстановителем цинка из цинкита, при более высоких температурах пары цинка могут восстанавливать железо из вюстита:
| (8) |
Таким образом, восстановление цинка из цинкита оксидом углерода CO возможно лишь при температурах выше 1320 °С (на 400 °С выше температуры кипения цинка) с получением цинка только в парообразном состоянии. Фактически реакции (4), (5) и (8) протекают параллельно и восстановленное железо фактически является катализатором для реакции (5). Практическая реализация процесса косвенного восстановления не реальна по причине низких значений ΔG° реакций (4), (5), (8).
Процессы восстановления железа и цинка из оксидов твердым углеродом осуществляются по реакциям (9) и (10):
| 2FeО(тв, ж) + 2С(тв) = 2Fe(тв, ж) + 2СО; | (9) |
| 2ZnО(тв) + 2С(тв) = 2Zn(ж, г) + 2СО. | (10) |
Начало восстановления для реакции (9) характеризуется на рис. 3 точкой А – пересечением линий ΔG° = f (T) для реакций (6) и (11):
| 2С + O2 = 2СО, | (11) |
для реакции (10) – точкой K – пересечением линий ΔG° = f (T) для реакций (11) и (12):
| 2Zn(г) + О2 = 2ZnО(тв). | (12) |
Параметры точки А: tнач ≈ 650 °С, PCO:PCO2 ≈ 1,1, PO2 ≈ 10\(^-\)21 ат; \(\Delta G_{\rm{(9)нач}}^{\rm{o}} \) = 0 (точка А′); для точки K: tнач ≈ 960 °С (примерно на 330 °С меньше, чем для реакции (5)), PCO:PCO2 ≈ 102, PO2 ≈ 10\(^-\)19 ат; \(\Delta G_{\rm{(10)нач}}^{\rm{o}}\) = 0 (точка K′).
Выше температуры 960 °С во всем интервале температур реакция (9) обладает значительным преимуществом по отношению к реакции (10) (\(\Delta G_{\rm{(9)}}^{\rm{o}} \) – \(\Delta G_{\rm{(10)}}^{\rm{o}} \) = –80 кДж).
При совместном восстановлении железа и цинка присутствие углерода обуславливает возможность образования тройного карбида Fe3ZnC [12], сосуществующего при температурах мерее 780 °С с α-железом (при содержании цинка в твердом растворе на основе α-железа менее 46 % и углерода более 4 %) и «Г» фазы с содержанием цинка 71 – 74 %, которая разлагается при температуре 780 °С по перитектической реакции (13) с образованием α-железа и жидкой фазы, содержащей примерно 7 % Fe, 89 % Zn, 4 % C:
| «Г» → (α-Fe + Zn) + ж. | (13) |
Присутствие углерода лимитирует процессы восстановления за счет ограничения состава газовой фазы (отношение CO:CO2) в соответствии с константой равновесия реакции Будуара (6).
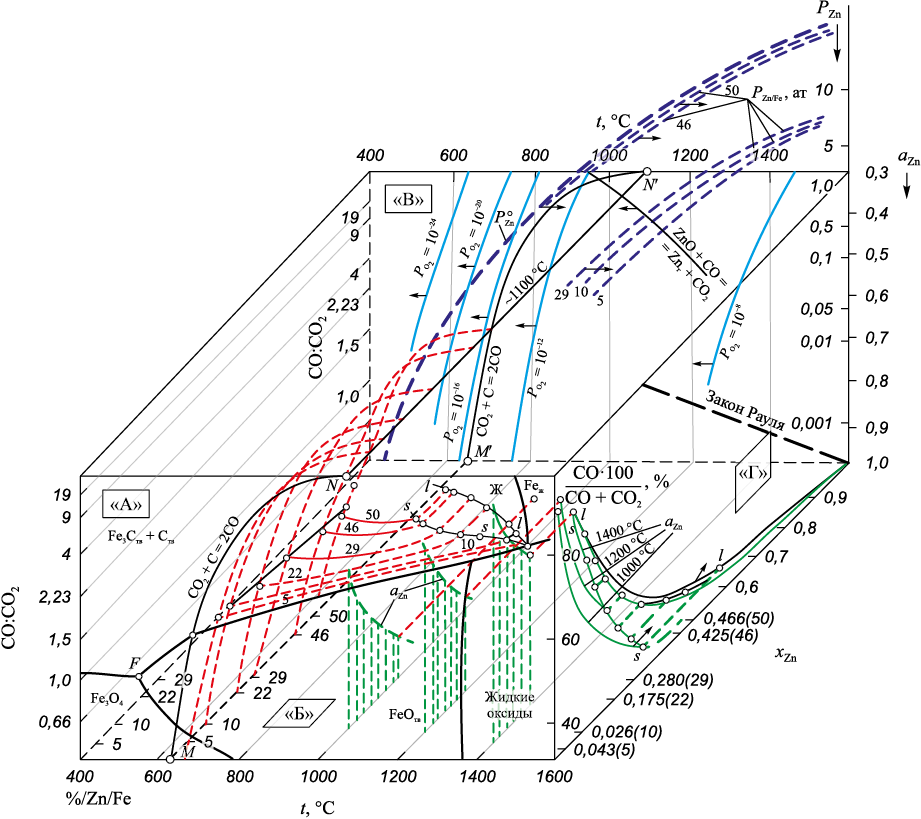
На представленной объемной диаграмме (рис. 4, грань А) показано, что в присутствии твердого углерода температура восстановления железа из вюстита соответствует tнач ≈ 690 °С (при образовании цементита Fe3C tнач ≈ 680 °С) при соотношении в газовой фазе CO:CO2 ≈ 1,5. При избытке углерода концентрация оксида углерода CO в газовой фазе соответствует равновесной для реакции (6), соотношение CO:CO2 составляет при 690 °С примерно 1,5; при 900 °С – примерно 19; при более высоких температурах содержание оксида углерода CO практически 100 % (CO:CO2 ≥ 102) (рис. 4).
Рис. 4. Физико-химические параметры системы Fe – Zn – O – C |
Аналогично при восстановлении цинка углеродом по реакции (10) при температуре начала восстановления tнач ≈ 960 °С и выше CO:CO2 ≥ 102.
Следует отметить, что при низких температурах (менее 1200 °С) активности железа и углерода незначительно отличаются от их мольных концентраций [14] и их изменение в твердых растворах и расплавах Fe – Zn не влияет существенно на равновесие реакций (9) и (10).
При совместном углеродотермическом восстановлении смеси оксидов цинка и железа первичным продуктом восстановления являются кристаллические зародыши железа, образующиеся по реакциям (1) (в интервале температур 580 – 1535 °С) и (5) (выше температуры 700 °С вплоть до образования железоуглеродистого расплава). Восстановление цинка с переходом его в зародыши железа с образованием твердых растворов на основе α-железа начинается практически одновременно с образованием новой фазы (α-железа), аналогично тому, как это происходит при совместном восстановлении марганца и кремния (в первичных мельчайших каплях металла (MnCx ) присутствует 5 – 8 % кремния [16]); при плавке карбида кальция в первичных каплях металла, образовавшихся в низкотемпературных горизонтах ванны руднотермической печи, обнаруживается также до 8 % кремния в железистом сплаве). Следует иметь в виду, что в сплавах Mn – Si, Fe – Si наблюдаются сильные отрицательные отклонения от закона Рауля (γSi ≈ 10\(^-\)3), а в сплавах Fe – Zn с низкими концентрациями цинка (xZn < 0,2) – положительные отклонения γZn[Fe] = 4 ÷ 10 (рис. 2), в связи с чем, учитывая высокую упругость пара цинка и возможность образования легкоплавких пленок расплавов на поверхности зародышей α-железа и интенсивное испарение цинка с их поверхностей, а также кинетические трудности диффузии цинка внутрь твердофазных зародышей, можно полагать, что большая часть цинка переходит в парогазовую фазу, а равновесные состояния твердый металл – шлак – газ практически недостижимы.
Результаты расчета термодинамических параметров системы Fe – Zn – O – C представлены на рис. 4. Показано, что при возможном достижении концентрации цинка в твердом растворе α-Fe – 5 ÷ 10 % Zn при температурах 700 – 800 °С aZn = 0,9, а равновесное давление пара цинка составляет примерно 0,01 ат (рис. 1); в пересыщенных цинком поверхностных пленках PZn > 0,1 ат, а при температурах 1300 – 1200 °С достигает 1 ат.
Обсуждение результатов термодинамического анализа
Возможность совместного восстановления железа и цинка с образованием твердых растворов Fe – Zn в значительной степени зависит от температуры, скорости нагрева, времени изотермической выдержки, растворимости и энергии образования растворов.
Известно, например, что при взаимодействии углерода с кремнеземом фракции менее 100 мкм скорость восстановления увеличивается на 2 – 3 порядка [17].
Можно полагать, что такие факторы, как степень измельчения, смешение, компактирование реагентов (брикетирование, агломерация), значительно (на порядки) увеличивающие поверхности реагирования и обуславливающие увеличение избыточной энергии за счет механоэнергетической активации при дроблении, трении, обработке давлением, также приводят к снижению температуры начала совместного восстановления железа и цинка, резкому увеличению скорости реакций и возможности образования твердых растворов Fe – Zn с достаточно высокой концентрацией цинка.
Наилучший вариант смешения оксидов железа и цинка обеспечивается при использовании смеси компонентов на молекулярном уровне в химических соединениях (феррит, франклинит) или при высоких температурах в шлаковых расплавах. Показано [1], что цинк из феррита восстанавливается быстрее и при более низкой температуре (~800 °С), чем из чистого цинкита (~1000 °С), при этом даже при температурах 800 – 900 °С цинк в значительной степени возгоняется (при 800 °С \(P_{\rm{Zn}}^{\rm{o}} \) ≈ 0,6 ат; при 900 °С \(P_{\rm{Zn}}^{\rm{o}} \) > 0,9 ат).
Восстановление железа и цинка из шлаковых расплавов оксидом углерода CO зависит от температуры, состава газовой фазы, состава расплава и, соответственно, активности оксида FeO в расплаве, а также физических характеристик расплава (степени гомогенности, вязкости, межфазного поверхностного натяжения шлак – металл и шлак – газ, степени поверхностного взаимодействия, зависящей от количества шлака и газа, степени барботажа и эмульгирования гетерогенного шлака).
При восстановлении железа и цинка из шлаков твердым углеродом большое значение имеют такие физико-химические свойства углеродистого восстановителя, как реакционная способность, пористость, плотность, фракционный состав, смачиваемость металлическим и шлаковым расплавами.
В шлаках системы FeO – SiO2 , насыщенных кремнеземом, активность оксида железа FeO при содержании его в расплаве 0 – 55 % (xFeO < 0,5) мало зависит от состава и температуры (при 1350 – 1600 °С aFeO = 0,36 ÷ 0,37 [10; 18]. В присутствии основных оксидов, например, в шлаках системы FeO – SiO2 – (CaO + MgO) при 1600 °С в диапазоне концентраций FeO в пределах 0 – 50 % наблюдаются положительные отклонения от закона Рауля тем более значительные, чем выше основность шлака R = CaO:SiO2 и чем ниже температура. При 1600 °С в шлаках, насыщенных кремнеземом (SiO2 = 50 ÷ 60 %), при содержании оксида железа FeO 10, 20, 30 и 40 % aFeO составляет 0,15, 0,29, 0,45 и 0,55. При повышении основности шлака R до 1 значения активности оксида железа увеличиваются примерно в 1,5 раза. Аналогичные соотношения получены в работах [1; 19] при температурах 1250 и 1200 °С для шлаков с содержанием FeO 25 – 60 % основностью 0,33 – 1,0.
Таким образом, из шлаков с R ˂ 1 при aFeO < 1 восстановление железа оксидом углерода CO протекает более трудно, чем из чистого оксида.
Аналогичный вывод можно сделать относительно реакции (5). Смещение линий равновесных значений ΔG° = f (T) для реакции (4) при aFeO = 0,4 показано на рис. 3.
В большинстве углеродотермических технологических процессов для восстановления цинка из концентратов и отходов производств (вельц-процесс, PRIMUS и др.) с целью недопущения образования при температурах процесса (1150 – 1250 °С) большого количества легкоплавких жидких металлических и сложных оксидных эвтектических расплавов в шихтовую смесь в качестве загустителей добавляется песок и избыточное (до четырехкратного по отношению к стехиометрически необходимому) количество более крупного (до 5 мм) углеродистого восстановителя. Это приводит к образованию вязкого гетерогенного шлака с высоким содержанием оксида кремния (до 30 – 40 %) и, соответственно, к значительному снижению активности основных оксидов (в том числе ZnO) в шлаке и затрудняет восстановление цинка.
При взаимодействии оксидов цинка и кремния образуется двойное химическое соединение 2ZnO·SiO2 (виллемит – содержание ZnO составляет 73 %), плавящееся конгруэнтно при 1512 °С и образующее эвтектики с ZnO (SiO2 – 21 %, t = 1505 °С) и с SiO2 (SiO2 – 43 %, t = 1430 °С) (рис. 5, а). При температурах ниже 1430 °С в интервале концентраций ZnO в пределах 0 – 73 % в системе ZnO – SiO2 сосуществуют только твердые фазы: SiO2 и 2ZnO·SiO2 .
Рис. 5. Диаграмма состояния системы ZnO – SiO2 (а) и активности и коэффициенты активности компонентов в системе ZnO – SiO2 (б): |
В присутствии (или при добавлении в шихтовые смеси) основных оксидов (CaO, MgO, FeO, MnO) температура плавления шлаков снижается (например, в направлении e1 – Et на рис. 5, а) вплоть до температур плавления тройных или более сложных эвтектик (~1000 °С), а в присутствии Na2O до 800 °С), при этом возможно также образование сложных цинксодержащих соединений типа xMeO·yZnO·zSiO2 (x, y, z = 1 или 2).
Активность оксида цинка aZn в эвтектических расплавах может изменяться существенно и достигать значений 0,1, что значительно затрудняет восстановление цинка. На рис. 3 показано изменение параметров функции ΔG° = f (T) для реакции (10) при aZn = 1 и aZn = 0,1. При 1200 °С разница между значениями ΔG(10) при aZn = 1 и aZn = 0,1 составляет ~30 % (70 и 50 кДж). В работах [1; 2] показано, что в шлаках с содержанием цинка 0,5 – 10 % замена оксида кальция оксидом железа FeO не приводит к изменению коэффициента активности оксида цинка, а изменение содержания мольной доли оксида кремния с 0,26 – 0,30 до 0,35 – 0,40 уменьшает коэффициент активности оксида цинка в 2,1 – 2,5 раза. Дальнейшее увеличение содержания SiO2 в шлаке до 44 – 46 % (мол.) (шлаки, насыщенные кремнеземом) не влияет на величину коэффициента активности оксида цинка.
Изменение активностей компонентов в системе ZnO – SiO2 при 1500 и 1600 °С представлены на рис. 5, б (на диаграмму нанесены в виде линий изоактивностей aZnO = f (xSiO2 , t = const) и aZnO = f (xSiO2 , t = const) (рис. 5, а). Наличие двухфазных областей на диаграмме состояния системы ZnO – SiO2 обусловило знакопеременную зависимость изотерм активностей компонентов и пересечение их с линиями закона Рауля в точках Ri (ai = xi , γi = 1), что позволяет достаточно корректно представить ход изотерм активностей [10].
В работе [20] показано, что в трехкомпонентных (и более сложных) системах даже в кислых шлаках (на линии насыщения кремнеземом) при добавлении основных оксидов (CaO, MgO и др.) активности их в первичных шлаках, образующихся в начале плавления, изменяются на порядки (от 0,1 – 0,6 до ~0,001). Необходимая корректная информация для конкретного технологического варианта и заданного режима (состав шихты, температура) может быть получена при проведении экспериментальных исследований.
Выводы
На базе существующих справочных данных и кинетических исследований сделана термодинамическая оценка условий совместного восстановления углеродом цинка и железа из оксидов, содержащихся в концентратах и отходах металлургического производства (пылях и шламах, образующихся при плавке стали в дуговых электросталеплавильных печах и конвертерах).
Построены зависимости активности цинка в твердых металлических растворах на основе α-железа и расплавах Fe – Zn в зависимости от их состава и температуры.
Построены зависимости активностей aZnO и aSiO2 в гомогенных расплавах системы ZnO – SiO2 при 1500 и 1600 °С. Показано, что в шлаках, насыщенных кремнеземом, активность оксидов цинка снижается с 0,37 при 1430 °С до 0,2 при 1600 °С.
При отсутствии в системе твердого углерода восстановление цинка из оксида оксидом углерода CO возможно при температурах выше 1320 °С. В присутствии твердого углерода восстановление цинка осуществляется при более низких температурах (на 300 – 350 °С). При 1200 °С и aZnO = 1 ΔG(10) ≈ 50 кДж, при ~1350 °С ΔG(10) = 100 кДж. При восстановлении из шлаков при aZnO ≤ 0,1 восстановление протекает при более высоких температурах (соответственно на 150 – 300 °С).
При совместном восстановлении цинка и железа из оксидов твердым углеродом первичным продуктом восстановления является твердое α-железо. Восстановленное железо при температурах выше 1000 °С является восстановителем и катализатором для реакции восстановления цинка.
Цинк интенсивно испаряется из металлических расплавов Fe – Zn и твердых растворов α-Fe – Zn, в том числе и твердых кристаллических зародышей. Даже при содержании цинка в растворах менее 5 % при 1300 °С равновесное давление пара цинка над растворами достигает 1 ат, что позволяет достигать высокой степени обесцинкования цинксодержащих концентратов и отходов металлургического производства способами углеродотермического восстановления.
Список литературы
1. Лакерник М.М. Электротермия в металлургии меди, свинца, цинка. Москва: Металлургия; 1971:296.
2. Тарасов А.В., Бессер А.Д., Мальцев В.И. Металлургическая переработка вторичного цинкового сырья. Москва: Гинцветмет; 2004:219.
3. Saramak D., Krawczykowski D., Gawenda T. Investigations of zinc recovery from metallurgical waste. IOP Conference Series: Materials Science and Engineering. 2018;427:012017. https://doi.org/10.1088/1757-899X/427/1/012017
4. Козлов П.А. Вельц-процесс. Москва: ИД «Руда и металлы», 2002:175.
5. Металлургические технологии переработки техногенных месторождений, промышленных и бытовых отходов / С.Н. Кузнецов, Е.П. Волынкина, Е.В. Протопопов, И.В. Зоря. Новосибирск: Изд-во СО РАН; 2014:294.
6. Ивановская М.И., Толстик А.И., Котиков Д.А., Паньков В.В. Структурные особенности Zn – Mn-феррита, синтезированного методом распылительного пиролиза. Журнал физической химии. 2009;83(12):2283–2288.
7. Dinel’t V.M., Anikin A.E., Strakhov V.M. Reduction of iron ore by means of lignite semicoke. Coke and chemistry. 2011;54(5):165–168. https://doi.org/10.3103/S1068364X11050048
8. Nokhrina O.I., Rozhihina I.D., Hodosov I.E. The use of coal in a solid phase reduction of iron oxide. IOP Conference Series: Materials Science and Engineering. 2015;91:012045. https://doi.org/10.1088/1757-899X/91/1/012045
9. Диаграммы состояния двойных металлических систем. Справочник / Под общ. ред. Н.П. Лякишева. Москва: Машиностроение; 1997:1024.
10. Эллиот Д.Ф., Глейзер М., Рамакршина В. Термохимия сталеплавильных процессов. Москва: Металлургия; 1969:252.
11. Shcherban A.P. Dependence of interphase distribution coefficients on temperature and concentration of components in double metal systems. East European Journal of Physics. 2020;(4):63–68. https://doi.org/10.26565/2312-4334-2020-4-08
12. Кубашевски О. Диаграммы состояния двойных и многокомпонентных систем на основе железа. Москва: Металлургия, 1985:184.
13. Khina B.B., Goranskiy G.G. Thermodynamic properties of multicomponent amorphous alloys in Fe–Si–B–Ni and Fe–Si–B–Ni–CO–Cr–Mo systems. Advanced Materials and Technologies. 2016;(2):8–15. https://doi.org/10.17277/amt.2016.02.pp.008-015
14. Massardier V., Merlin J., Le Patezour E., Soler M. Mn–C interaction in Fe–C–Mn steels: Study by thermoelectric power and internal friction. Metallurgical and Materials Transactions A. 2005;36:1745–1755. https://doi.org/10.1007/s11661-005-0039-x
15. Якушевич Н. Ф., Кавешников А.А. Термодинамический анализ системы CaO – SiO2 – TiO2 в состояниях инвариантных равновесий. Известия вузов. Черная металлургия. 2004;47(6):7–11.
16. Атлас шлаков / Перевод с нем. Г.И. Жмойдина / Под ред. И.С. Куликова. Москва: Металлургия; 1985:208.
17. Nikolaychuk P.A. Thermodynamic evaluation of electrochemical stability of Me – Si systems (Me = 4th row transition metal). Journal of Siberian Federal University. Chemistry. 2015;8(2):160–180. https://doi.org/10.17516/1998-2836-2015-8-2-160-180
18. Bertoli A.C., Garcia J.S., Trevisan M.G., Ramalho T.C., Freitas M.P. Interactions fulvate-metal (Zn2+, Cu2+ and Fe2+): theoretical investigation of thermodynamic, structural and spectroscopic properties. Biometals. 2016;29:275–285. https://doi.org/10.1007/s10534-016-9914-8
19. Prostakova V., Shishin D., Shevchenko M., Jak E. Termodynamic optimization of the Al2O3 – FeO – Fe2O3 – SiO2 oxide system. Calphad. 2019;67:101680. https://doi.org/10.1016/j.calphad.2019.101680
20. Sokol’skii V.E., Galinich V.I., Kazimirov V.P., Batalin G.I., Shovskii V.A. Structure of the molten ternary silicate systems MnO–TiO2–SiO2 and MnO–ZrO2–SiO2. Melts. 1989;1(6): 513–519.
Об авторах
Н. Ф. ЯкушевичРоссия
Николай Филиппович Якушевич, д.т.н., профессор-консультант кафедры металлургии цветных металлов и химической технологии
Россия, 654007, Кемеровская обл. – Кузбасс, Новокузнецк, ул. Кирова, 42
Е. В. Протопопов
Россия
Евгений Валентинович Протопопов, д.т.н., профессор кафедры металлургии черных металлов
Россия, 654007, Кемеровская обл. – Кузбасс, Новокузнецк, ул. Кирова, 42
М. В. Темлянцев
Россия
Михаил Викторович Темлянцев, д.т.н., профессор, проректор по учебной и воспитательной работе
Россия, 654007, Кемеровская обл. – Кузбасс, Новокузнецк, ул. Кирова, 42
И. В. Строкина
Россия
Ирина Владимировна Строкина, к.т.н., старший преподаватель кафедры металлургии цветных металлов и химической технологии
Россия, 654007, Кемеровская обл. – Кузбасс, Новокузнецк, ул. Кирова, 42
Рецензия
Для цитирования:
Якушевич Н.Ф., Протопопов Е.В., Темлянцев М.В., Строкина И.В. Термодинамическая оценка условий совместного восстановления цинка и железа углеродом из оксидов концентратов и отходов металлургических производств. Известия высших учебных заведений. Черная Металлургия. 2023;66(4):459-470. https://doi.org/10.17073/0368-0797-2023-4-459-470
For citation:
Yakushevich N.F., Protopopov E.V., Temlyantsev M.V., Strokina I.V. Thermodynamic assessment of conditions for co-reduction of zinc and iron by carbon from oxides of concentrates and waste from metallurgical enterprises. Izvestiya. Ferrous Metallurgy. 2023;66(4):459-470. https://doi.org/10.17073/0368-0797-2023-4-459-470
JATS XML