Перейти к:
Раскислительная способность алюминия в железо-марганцевых углеродсодержащих расплавах
https://doi.org/10.17073/0368-0797-2023-2-206-214
Аннотация
Раскисление (снижение концентрации растворенного в жидком металле кислорода) является неотъемлемой частью технологии производства сталей. Для получения глубоко раскисленного металла на металлургических предприятиях применяется в основном алюминий. Необходимо учитывать, что легирующие элементы сталей и сплавов при определенных условиях могут выступать как элементы-раскислители, внося вклад в комплексный характер процесса раскисления. Практически все стали содержат марганец в той или иной концентрации. Изучение процессов взаимодействия в системе Fe – Mn – Al – O – С при температурах сталеварения имеет прикладное значение. В настоящей работе проводится термодинамический анализ раскислительной способности алюминия в кислородсодержащих железо-марганцевых расплавах. При этом учитывается влияние углерода на ход процесса раскисления. Эффективным в исследовании является применение методики построения поверхности растворимости компонентов в металле (ПРКМ) – диаграммы, которая связывает составы жидкого металла с составами сопряженных неметаллических фаз. В ходе настоящей работы были рассчитаны изотермы растворимости кислорода в системе Fe – Mn – O для интервала температур 1550 – 1650 °С. Для системы Fe – Mn – Al – O – С (1600 °С) построены изосоставные сечения ПРКМ при фиксированных концентрациях углерода в стали [C] = 0; 0,1; 0,4; 0,8 и 1,2 % (здесь и далее по массе). При одновременном присутствии марганца и алюминия в кислородсодержащем расплаве на основе железа (при промышленно значимых концентрациях [Al] 0,001 – 0,010 % и [Mn] менее 1,0 %) алюминий в жидком металле будет выступать как раскисляющий агент, а в качестве продуктов взаимодействия будут образовываться включения корунда. Комплексное раскисление алюминием и марганцем с образованием шпинели характерно только для легированных марганцем сталей, где концентрация марганца составляет более 1,5 %.
Ключевые слова
Для цитирования:
Макровец Л.А., Самойлова О.В., Михайлов Г.Г. Раскислительная способность алюминия в железо-марганцевых углеродсодержащих расплавах. Известия высших учебных заведений. Черная Металлургия. 2023;66(2):206-214. https://doi.org/10.17073/0368-0797-2023-2-206-214
For citation:
Makrovets L.A., Samoilova O.V., Mikhailov G.G. Deoxidation capacity of aluminum in ferromanganese carbon-containing melts. Izvestiya. Ferrous Metallurgy. 2023;66(2):206-214. (In Russ.) https://doi.org/10.17073/0368-0797-2023-2-206-214
Введение
Раскисление – один из важнейших технологических процессов при производстве сталей. Именно на этом этапе определяется количество остаточного кислорода в металле, формируются оксидные неметаллические включения (НВ), размер, форма и состав которых во многом определяют качество выпускаемой металлопродукции. Для раскисления большинства сталей практически обязательным условием является применение алюминия, благодаря его относительной дешевизне, возможности получения глубоко раскисленного металла и технологическому удобству использования [1]. На производстве обычно проводится комплексное раскисление, где наряду с алюминием в жидкий металл вводятся и другие раскислители (Si – Mn, Si – Ca и др.) [2; 3]. На ход процесса раскисления также влияет состав стали. Легирующие элементы в определенных условиях могут выступать как элементы-раскислители, что не всегда желательно для производства качественного металла. С учетом того, что практически все стали содержат марганец (от 0,4 до 20,0 % (здесь и далее по массе) в зависимости от марки стали), изучение процессов взаимодействия элементов в системе Fe – Mn – Al – O – C при температурах сталеварения является актуальным.
В работах [4; 5] показано, что марганец усиливает раскислительную способность алюминия, если содержание алюминия не превышает 0,05 %. В работе [6] не отмечается значительного влияния марганца на раскислительную способность алюминия. Механизм раскисления при одновременном присутствии марганца и алюминия в углеродсодержащем расплаве на основе железа требует уточнений и дальнейших исследований.
Для оценки раскислительной способности элементов в жидкой стали была разработана методика построения поверхности растворимости компонентов в металле (ПРКМ), базирующаяся на термодинамическом моделировании процессов взаимодействия компонентов в расплаве металла [7; 8]. Рассматриваемая методика представляет собой диаграмму, связывающую составы жидкого металла с составами сопряженных неметаллических фаз. Таким образом, фактически ПРКМ – это диаграмма стабильности фаз НВ, определяющая концентрационные границы областей формирования оксидных соединений в зависимости от состава металлического расплава (включая концентрацию растворенного в жидком железе кислорода). Это позволяет учитывать градиент концентраций по ходу процесса раскисления, что говорит о широкой области применимости проводимого термодинамического моделирования.
Целью настоящей работы является термодинамический анализ раскислительной способности алюминия в железо-марганцевых углеродсодержащих расплавах методом построения ПРКМ системы Fe – Mn – Al – O – C при температуре 1600 °С и концентрациях углерода [C] 0; 0,1; 0,4; 0,8 и 1,2 %.
Методика моделирования
Подробно методика расчета ПРКМ описана в работе [9], но кратко ее можно представить следующим образом. Определяется количество химических реакций, протекающих в металлическом расплаве исследуемой системы при взаимодействии элементов с растворенным в жидком металле кислородом. Для каждой из реакций записывается константа равновесия, включающая активности участвующих веществ. Активности компонентов металлического расплава определяются через их равновесные концентрации и параметры взаимодействия первого порядка по Вагнеру. Активности компонентов оксидного расплава (в случае рассмотрения возможности образования жидких НВ) описываются, используя выбранную термодинамическую модель. Активности компонентов твердого раствора оксидов и/или шпинелей (в случае возможности образования твердых растворов в качестве сложных НВ) рассматриваются через выбранную термодинамическую модель, оптимальную для рассматриваемой системы. Активности чистых твердых веществ (в случае образования чистых оксидов в качестве НВ) принимаются равными единице. Активности компонентов газовой фазы выражаются через парциальные давления, при этом общее давление в системе принимается 1 атм. (0,1 МПа). Записывается система уравнений, где в качестве неизвестных величин выступают концентрации компонентов жидких металла и оксидных НВ (оксидного расплава), составы твердых растворов оксидов и/ или шпинелей, а также парциальные давления компонентов газовой фазы. Полученные при расчете результаты представляются графически в виде диаграммы, связывающей составы жидкого металла с составами образующихся при раскислении неметаллических включений.
Для расчета ПРКМ системы Fe – Mn – Al – O – C необходимо рассмотреть предварительно ПРКМ систем Fe – Al – O и Fe – Mn – O. Для системы Fe – Al – O ПРКМ была построена ранее в работе [7]. Для системы Fe – Mn – O ПРКМ была рассчитана в ходе настоящей работы для интервала температур 1550 – 1650 °С.
Ключевой для построения ПРКМ системы Fe – Mn – O является реакция взаимодействия между марганцем и кислородом (растворенных в жидком железе) с образованием в качестве продукта взаимодействия твердых частиц MnO. В табл. 1 представлены константы равновесия этой реакции для температуры 1600 °С, которые находятся в пределах –1,335 [10], –1,353 [17], –1,253 [14], за исключением значений –0,942 [15] и –1,760 [16]. В настоящей работе было использовано lgK|MnO| = –1,265 при температурной зависимости, приведенной в работах [11; 12].
Таблица 1. Температурные зависимости для константы равновесия
|
Используемые при расчете ПРКМ Fe – Mn – O и Fe – Mn – Al – O – C зависимости для констант равновесия реакций от температуры приведены в табл. 2. Сведения о возможных продуктах взаимодействия в исследуемых системах были определены, исходя из диаграмм состояния систем FeO – MnO и FeO – MnO – Al2O3 [19]. Активности компонентов оксидных расплавов (FeO, MnO) и (FeO, MnO, Al2O3 ) рассчитывали по теории субрегулярных ионных растворов, энергетические параметры которой приведены в табл. 3. Активности компонентов твердого раствора оксидов |FeO, MnO|тв.р в системе Fe – Mn – O рассчитывали с использованием теории регулярных ионных растворов (Q12 = +5034 Дж/ моль [19]). При моделировании фазовых равновесий с участием твердых растворов оксидов с использованием теории регулярных ионных растворов в системе Fe – Mn – Al – O – C учитывали, что оксид FeO неограниченно растворяется в оксиде MnO (Q12 = +5034 Дж/моль), а соединение Al2O3 ограниченно растворяется в оксиде MnO (Q22 = +17 713 Дж/ моль). Принимали, что в твердом растворе |FeO, MnO|тв.р частично растворяется оксид Al2O3 [19], то есть твердый раствор оксидов будет состоять из оксидов железа, марганца и следов оксида алюминия. Твердый раствор шпинелей |FeAl2O4 , MnAl2O4 |тв.р рассчитывали с использованием теории совершенных растворов.
Таблица 2. Температурные зависимости для констант равновесия реакций, протекающих в металлическом расплаве систем
Таблица 3. Энергетические параметры теории субрегулярных
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Параметры взаимодействия первого порядка по Вагнеру для расчета активностей компонентов металлического расплава приведены в табл. 4. В работе [24] был проведен анализ влияния параметра взаимодействия \(e_{\rm{O}}^{{\rm{Mn}}}\) в интервале от –0,01 до –0,07 на раскислительную способность марганца. Влияние параметра усиливается при концентрациях марганца в жидком металле более 1 %. Согласно проведенным расчетам снижение параметра \(e_{\rm{O}}^{{\rm{Mn}}}\) до –0,07 приводит к сдвигу максимальной раскислительной способности марганца в сторону меньших его концентраций (примерно 6 – 7 %), что не согласуется с экспериментальными данными [11; 15; 25]. Поэтому было использовано значение \(e_{\rm{O}}^{{\rm{Mn}}}\) = –0,021 [17].
Таблица 4. Параметры взаимодействия первого порядка
| |||||||||||||||||||||||||||||||||||||
Результаты и их обсуждение
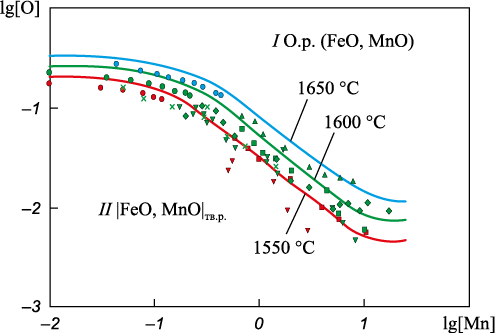
На рис. 1 приведены результаты расчета координат ПРКМ системы Fe – Mn – O: в области I определены составы жидкого металла, равновесного с оксидным расплавом (О.р.) переменного состава (FeO, MnO); в области II – с твердым раствором оксидов |FeO, MnO|тв.р . Для концентрации марганца 0,1 % (lg [Mn] = –1) в качестве НВ в металле образуется оксидный расплав, концентрация ионов железа \({x_{{\rm{F}}{{\rm{e}}^{2+ }}}}\) в этом расплаве согласно расчетам составляет 0,791 для температуры 1600 °С. Для области образования твердого раствора оксидов в качестве НВ (рис. 1, область II) при концентрации марганца 0,5 % (lg [Mn] = –0,3) для температуры 1600 °С ионная доля железа в твердом растворе составляет 0,229; при 1,0 % (lg [Mn] = 0) значение \({x_{{\rm{F}}{{\rm{e}}^{2+ }}}}\) снижается до 0,120; при 10 % (lg [Mn] = 1) \({x_{{\rm{F}}{{\rm{e}}^{2+ }}}}\) = 0,011. На основании проведенного термодинамического анализа можно сделать вывод о слабой раскислительной способности марганца в жидком железе и достаточно высокой концентрации ионов железа в продуктах раскисления.
Рис. 1. Фазовые равновесия в жидком металле системы Fe–Mn–O |
При сравнении расчетных линий и экспериментальных точек (рис. 1) видно, что наибольшее совпадение имеется с данными работы [11]. Наименьшая раскислительная способность марганца в жидком железе определена в работе [24], что противоречит как настоящей работе, так и большинству экспериментальных данных [11; 15; 25].
В работах [27; 28] можно встретить результаты моделирования равновесных концентраций кислорода для системы Fe – Mn – O. Отметим, что по расчетам из работы [27] максимум раскислительной способности марганца не наступает даже при [Mn] = 50 %. Результаты моделирования, полученные в настоящей работе, согласуются с экспериментальными данными работ [11; 24; 25] и с расчетными данными [28], где максимум раскислительной способности марганца приходится на 10 – 15 % [Mn].
На рис. 2 приведено изотермическое (1600 °С) сечение ПРКМ системы Fe – Mn – Al – O – С: в области I определены составы жидкого металла, равновесного с оксидным расплавом переменного состава (FeO, MnO, Al2O3); в области II – с твердым раствором оксидов (Тв. р. ок.) |FeO, MnO, Al2O3 |тв.р ; в области III – с твердым раствором шпинелей |FeAl2O4 , MnAl2O4 |тв.р ; в области IV – с корундом; в области V – с газовой фазой {CO, CO2 }.
Рис. 2. Фазовые равновесия в жидком металле при температуре 1600 °С для системы |
При [C] = 0 % (рис. 2, а) для [Al] более 10\(^{-}\)4 % образование жидких оксидных НВ (О.р.) и твердого раствора оксидов в процессе раскисления термодинамически маловероятно. Для [Mn] менее 1,0 % при промышленно значимых концентрациях алюминия [Al] = 0,001 – 0,010 % основным НВ в металле будет корунд. Для концентраций [Mn] более 1,5 % при тех же самых концентрациях алюминия появляется возможность образования частиц твердого раствора шпинелей, а при [Mn] = 10 % частицы шпинели становятся доминирующими НВ. При этом надо отметить, что для концентраций марганца 2,5 % (lg [Mn] = 0,4) и алюминия 0,005 % (lg [Al] = –2,3) мольная доля \({x_{{\rm{FeAl}}{_{\rm{2}}}{{\rm{O}}_{\rm{4}}}}}\) в шпинели |FeAl2O4 , MnAl2O4 |тв.р составляет 0,031; для концентраций марганца порядка 10 % (lg [Mn] = 1) и той же концентрации алюминия \({x_{{\rm{FeAl}}{_{\rm{2}}}{{\rm{O}}_{\rm{4}}}}}\) = 0,007. Таким образом, при значимых концентрациях алюминия возможность образования НВ с герцинитом ничтожно мала.
В присутствии углерода (рис. 2, б, в) в системе возможно образование газовой фазы {CO, CO2 }. Чем больше концентрация углерода, тем область равновесия жидкого металла с газом становится обширнее. Однако границы рассматриваемой области согласно термодинамическому моделированию смещены в сторону малых концентраций алюминия. Таким образом, при введении алюминия в углеродсодержащий железо-марганцевый расплав для концентраций алюминия [Al] = 0,001 – 0,010 % в качестве основных НВ будут выступать частицы твердого раствора шпинелей (область III) и корунда (область IV), при этом в шпинели |FeAl2O4 , MnAl2O4 |тв.р значение \({x_{{\rm{FeAl}}{_{\rm{2}}}{{\rm{O}}_{\rm{4}}}}}\) не будет превышать 0,05. В указанном интервале концентраций алюминия образование жидких оксидных НВ (О.р.), твердого раствора оксидов и газовой фазы будет термодинамически маловероятно.
Согласно проведенной термодинамической оценке алюминий обладает более сильной раскислительной способностью по сравнению с марганцем в жидком железе. Так, для достижения концентрации кислорода в металле 0,01 % (lg [O] = –2) требуется всего лишь 0,0002 % алюминия, в то время как марганца необходимо 7,6 %.
Комплексное раскисление алюминием и марганцем с образованием в качестве НВ твердого раствора шпинелей (область III) для [Al] = 0,001 – 0,010 % характерно только для сталей, легированных марганцем (концентрация марганца должна быть более 1,5 %). При более низких концентрациях марганца алюминий будет выступать основным элементом-раскислителем с образованием корунда в качестве НВ.
По результатам моделирования минимальное содержание кислорода [O]min составляет 0,00016 % и соответствует [Al] = 0,32 %, что сопоставимо с расчетными данными работы [28], согласно которым [O] min = 0,00020 % наблюдается при [Al] = 0,63 %. Также расчет по очередности фазообразования хорошо согласуется с экспериментальными данными работы [30].
На рис. 2, а приведены экспериментальные данные работ [11; 29]. Экспериментальные точки работы [11] относятся к НВ в виде алюминатов марганца и железа, что согласуется с проведенным в настоящей работе моделированием. Имеется небольшое отличие расчетов от данных работы [29] по концентрационным границам области существования твердого раствора шпинелей, однако угол наклона линий одинаков, что говорит о схожей трактовке характера раскисления, реализующегося в системе.
Отдельно были рассмотрены фазовые равновесия в исследуемой системе для концентраций, характерных для стали Гадфильда. Эта сталь отличается повышенной прочностью и износостойкостью не только благодаря концентрации углерода порядка 0,8 – 1,2 %, но и высокой концентрации марганца (примерно 13 %) [31; 32]. На рис. 3 приведено изотермическое сечение (1600 °С) ПРКМ системы Fe – Mn – Al – O – С для концентраций углерода 0,8 и 1,2 %. Обозначения на рис. 3 совпадают с обозначениями на рис. 2.
Рис. 3. Фазовые равновесия в жидком металле при температуре 1600 °С |
Согласно полученным расчетам для высокоуглеродистой высокомарганцевой стали Гадфильда при [Al] = 0,001 – 0,010 % характерно комплексное раскисление с образованием частиц твердого раствора шпинелей |FeAl2O4 , MnAl2O4 |тв.р . При меньших концентрациях алюминия в расплаве возможно образование газовой фазы {CO, CO2}, что крайне нежелательно (при больших концентрациях алюминия возможно образование корунда).
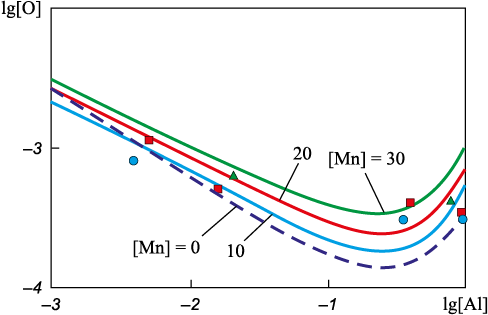
На рис. 4 приведены результаты расчета изосоставных сечений ПРКМ (1600 °С) системы Fe – Mn – Al – O при [Mn] = 0; 10; 20 и 30 %. Видно, что результаты моделирования согласуются с данными работы [33].
Рис. 4. Изосоставные сечения ПРКМ (1600 °С) системы Fe – Mn – Al – O |
Значительное увеличение концентрации марганца практически не влияет на раскислительную способность алюминия в железо-марганцевых расплавах (рис. 4). Максимум раскислительной способности для всех четырех концентраций марганца приходится на концентрацию алюминия примерно 0,3 %. При этом с увеличением концентрации [Mn] незначительно повышается концентрация остаточного кислорода в системе (от [O]min = 0,00020 % при [Mn] = 10 % до [O] min = 0,00032 % при [Mn] = 30 %). Таким разбросом значений по концентрации кислорода можно пренебречь.
Выводы
Проведен термодинамический анализ раскислительной способности алюминия в железо-марганцевых углеродсодержащих расплавах методом построения ПРКМ системы Fe – Mn – Al – O – C при температуре 1600 °С и [C] = 0; 0,1; 0,4; 0,8; 1,2 %. Показано, что алюминий обладает большей раскислительной способностью по сравнению с марганцем в жидком железе и образование корунда в жидкой стали при введении алюминия в углеродсодержащий железо-марганцевый расплав наиболее вероятно. Однако для концентраций марганца более 1,5 % при промышленно значимых концентрациях алюминия (0,001 – 0,010 %) возможен и комплексный характер раскисления в системе с образованием частиц |FeAl2O4 , MnAl2O4|тв.р , где мольная доля FeAl2O4 не будет превышать 0,05. В присутствии углерода в системе возможно образование газовой фазы {CO, CO2} (чем больше концентрация углерода, тем область равновесия жидкого металла с газом становится обширнее). Однако границы этой области согласно термодинамическому моделированию смещены в сторону ультрамалых концентраций алюминия. Согласно полученным расчетам для высокоуглеродистой высокомарганцевой стали Гадфильда при [Al] = 0,001 – 0,010 % характерно комплексное раскисление с образованием частиц твердого раствора шпинелей |FeAl2O4 , MnAl2O4 |тв.р . Анализ результатов расчета изосоставных сечений ПРКМ при температуре 1600 °С системы Fe – Mn – Al – O для [Mn] = 0, 10, 20 и 30 % показал, что увеличение концентрации марганца практически не влияет на раскислительную способность алюминия в железо-марганцевых расплавах.
Список литературы
1. Paek M.K., Jang J.M., Kang Y.B., Pak J.J. Aluminum deoxidation equilibria in liquid iron: Part I. Experimental. Metallurgical and Materials Transactions B. 2015;46(4): 1826–1836. https://doi.org/10.1007/s11663-015-0368-0
2. Харлашин П.С., Носенко О.А., Яценко А.Н. Разработка рациональной технологии раскисления спокойных марок стали. Вісник Приазовського державного технічного університету. Серія: Технічні науки. 2011;2(23):52–55.
3. Shapovalov A.N., Dema R.R, Nefed’ev S.P. Improving the efficiency of steel de-oxidation at the Ural steel. Materials Science Forum. 2020;989:400–405. https://doi.org/10.4028/www.scientific.net/MSF.989.400
4. Якушев А.М., Михайлов Э.Н., Кудрин В.А. Исследование раскисления стали комплексными раскислителями. В кн.: Производство стали и стальное литье. Москва: Металлургия; 1969:163–170.
5. Новохатский И.А., Белов Б.Ф. К термодинамике комплексного раскисления алюминием марганцовистого железа. Известия АН СССР. Металлы. 1969;(5):41–46.
6. Fischer W.A., Bardenheuer P.W. Die Gleichgewichte zwisсhen mangan-, aluminium- und sauerstoffhaltigen Eisenschmelzen und ihren Schlacken im Mangan (II)-oxydtiegel bei 1530 bis 1700 °C. Archiv für das Eisenhüttenwesen. 1968;39(9):637–643. (In Germ.). https://doi.org/10.1002/srin.196803570
7. Михайлов Г.Г., Самойлова О.В., Макровец Л.А., Смирнов Л.А. Термодинамическое моделирование изотерм растворимости кислорода в жидком металле системы Fe–Mg–Al–O. Известия вузов. Черная металлургия. 2019;62(8):639–645. https://doi.org/10.17073/0368-0797-2019-8-639-645
8. Mikhailov G.G., Makrovets L.A., Samoilova O.V. Phase equilibria in a liquid metal of Fe–La–Ce–O system at 1600 °C. Solid State Phenomena. 2020;299:468–474. https://doi.org/10.4028/www.scientific.net/SSP.299.468
9. Михайлов Г.Г., Леонович Б.И., Кузнецов Ю.С. Термодинамика металлургических процессов и систем. Москва: ИД МИСиС; 2009: 520.
10. Ohta H., Suito H. Activities of MnO in CaO–SiO2–Al2O3–MnO (<10 Pct)–FetO(<3 pct) slags saturated with liquid iron. Metallurgical and Materials Transactions B. 1995;26(2): 295–303. https://doi.org/10.1007/bf02660972
11. Dimitrov S., Weyl A., Janke D. Control of the manganese-oxygen reaction in pure iron melts. Steel Research. 1995; 66(3):87–92. https://doi.org/10.1002/srin.199501092
12. Chipman J., Gero J.B., Winhler T.B. The manganese equilibrium under simple oxide slags. Transactions of AIME. 1950; 188:341–345.
13. Steelmaking Data Sourcebook, Japan Society for the Promotion of Science. The 19th Committee on Steelmaking. New York: Gordon and Breach Science Publishers; 1988:125.
14. Shibata H., Tanaka T., Kimura K., Kitamura S.-Y. Composition change in oxide inclusions of stainless steel by heat treatment. Ironmaking and Steelmaking. 2010;37(7):522–528. https://doi.org/10.1179/030192310x12700328925903
15. Линчевский Б.В., Самарин А.М. Растворимость кислорода в расплавах железа с марганцем. Известия АН СССР. ОТН. 1957;(2):9–18.
16. Лузгин В.П., Вишкарев А.Ф., Явойский В.И. Определение раскислительной способности элементов методом электродвижущих сил. Известия вузов. Черная металлургия. 1963;6(9):50–54.
17. Li S., Cheng G., Yang L., Chen L., Yan Q., Li C.A. A thermodynamic model to design the equilibrium slag compositions during electroslag remelting process: Description and verification. ISIJ International. 2017;57(4):713–722. https://doi.org/10.2355/isijinternational.isijint-2016-655
18. Fuwa T., Chipman J. The carbon–oxygen equilibria in liquid iron. Transactions of AIME. 1960;218:887–891.
19. Михайлов Г.Г., Макровец Л.А., Самойлова О.В. Термодинамическое моделирование диаграмм состояния двойных и тройных оксидных систем, принадлежащих к системе FeO–MgO–MnO–Al2O3 . Новые огнеупоры. 2020;(6): 47–50. https://doi.org/10.17073/1683-4518-2020-6-47-50
20. Sigworth G.K., Elliott J.F. The thermodynamics of liquid dilute iron alloys. Metal Science. 1974;8(1):298–310. https://doi.org/10.1179/msc.1974.8.1.298
21. Ren Q., Zhang L. Effect of cerium content on inclusions in an ultra-low-carbon aluminum-killed steel. Metallurgical and Materials Transactions B. 2020;51(2):589–600. https://doi.org/10.1007/s11663-020-01779-y
22. Park J.H., Todoroki H. Control of MgO·Al2O3 spinel inclusions in stainless steels. ISIJ International. 2010;50(10): 1333–1346. https://doi.org/10.2355/isijinternational.50.1333
23. Itoh H., Hino M., Ban-Ya S. Assessment of Al deoxidation equilibrium in liquid iron. Tetsu-to-Hagané. 1997;83(12):773–778. https://doi.org/10.2355/tetsutohagane1955.83.12_773
24. Janke D., Fischer W.A. Gleichgewichte von Chrom und Mangan mit Sauerstoff in Eisenschmelzen bei 1600 °C. Archiv für das Eisenhüttenwesen. 1976;47(3):147–151. (In Germ.). https://doi.org/10.1002/srin.197603795
25. Шевцов В.Е., Меркер Э.Э., Лузгин В.П. Термодинамика растворов кислорода в железо-марганцевых расплавах. Известия вузов. Черная металлургия. 1987;30(7):1–3.
26. Hilty D.C., Crafts W. Solubility of oxygen in liquid iron containing silicon and manganese. Transactions of AIME. 1950; 188:425–436.
27. Jung I.-H., Decterov S.A., Pelton A.D. A thermodynamic model for deoxidation equilibria in steel. Metallurgical and Materials Transactions B. 2004;35(3):493–507. https://doi.org/10.1007/s11663-004-0050-4
28. Paek M.-K., Do K.-H., Kang Y.-B., Jung I.-H., Pak J.-J. Aluminum deoxidation equilibria in liquid iron: Part III – Experiments and thermodynamic modeling of the Fe–Mn–Al–O system. Metallurgical and Materials Transactions B. 2016; 47(5):2837–2847. https://doi.org/10.1007/s11663-016-0728-4
29. Kong L., Deng Z., Zhu M. Formation and evolution of non-metallic inclusions in medium Mn steel during secondary refining process. ISIJ International. 2017;57(9):1537–1545. https://doi.org/10.2355/isijinternational.ISIJINT-2017-118
30. Schürmann E., Bannenberg N. Die kombinierten Desoxidationsgleichgewichte mit Mangan, Aluminium und Silicium sowie ihre Bedeutung für die Einschlußbildung. Archiv für das Eisenhüttenwesen. 1984;55(10):455–462. (In Germ.). https://doi.org/10.1002/srin.198405375
31. Sabzi M., Farzam M. Hadfield manganese austenitic steel: A review of manufacturing processes and properties. Materials Research Express. 2019;6(10):1065c2. https://doi.org/10.1088/2053-1591/ab3ee3
32. Колокольцев В.М., Вдовин К.Н., Чернов В.П., Феоктистов Н.А., Горленко Д.А., Дубровин В.К. Исследование механизмов абразивного и ударно-абразивного изнашивания высокомарганцевой стали. Вестник МГТУ им. Г.И. Носова. 2017;15(2):54–62. https://doi.org/10.18503/1995-2732-2017-15-2-54-62
33. Nishigaki R., Matsuura H. Al deoxidation equilibrium of Fe–10–30 mass % Mn melt at 1873 K. Tetsu-to-Hagané. 2019;105(3):369–372. https://doi.org/10.2355/tetsutohagane.tetsu-2018-118
Об авторах
Л. А. МакровецРоссия
Лариса Александровна Макровец, инженер кафедры материаловедения и физико-химии материалов
Россия, 454080, Челябинск, пр. Ленина, 76
О. В. Самойлова
Россия
Ольга Владимировна Самойлова, к.х.н., старший научный сотрудник кафедры материаловедения и физико-химии материалов
Россия, 454080, Челябинск, пр. Ленина, 76
Г. Г. Михайлов
Россия
Геннадий Георгиевич Михайлов, д.т.н., профессор, старший научный сотрудник кафедры материаловедения и физико-химии материалов
Россия, 454080, Челябинск, пр. Ленина, 76
Рецензия
Для цитирования:
Макровец Л.А., Самойлова О.В., Михайлов Г.Г. Раскислительная способность алюминия в железо-марганцевых углеродсодержащих расплавах. Известия высших учебных заведений. Черная Металлургия. 2023;66(2):206-214. https://doi.org/10.17073/0368-0797-2023-2-206-214
For citation:
Makrovets L.A., Samoilova O.V., Mikhailov G.G. Deoxidation capacity of aluminum in ferromanganese carbon-containing melts. Izvestiya. Ferrous Metallurgy. 2023;66(2):206-214. (In Russ.) https://doi.org/10.17073/0368-0797-2023-2-206-214